เซลล์อิเล็กโทรไลต์ (Electrolytic Cell) คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานไฟฟ้าเป็นพลังงานเคมี เกิดจาก การผ่านกระแสไฟฟ้าเข้าไปในเซลล์ แล้วเกิดปฏิกิริยาเคมีขึ้น เช่น เซลล์แยกน้ำด้วยไฟฟ้า การชุบโลหะด้วยไฟฟ้า การใช้ปฏิกิริยาเคมีทำให้เกิดกระแสไฟฟ้าหรือการใช้กระแสไฟฟ้าทำให้เกิดการเปลี่ยนแปลงทางเคมีเกิดได้ในเซลล์ไฟฟ้าเคมี (Electrochemical Cell)
กระบวนการอิเล็กโทรไลซิส (Electrolysis) คือ กระบวนการผ่านกระแสไฟฟ้า (D.C.) จากภายนอกเข้าไปในสารละลายอิเล็กโทรไลต์ แล้วทำให้เกิดปฏิกิริยาเคมี ตัวอย่างเช่น อิเล็กโทรลิซึม และการชุบ (ขบวนการที่ผ่านกระแสไฟฟ้า ทำให้เกิดปฏิกิริยาเคมี)
เครื่องมือที่ใช้แยกสารละลายด้วยไฟฟ้าเรียกว่า เซลล์อิเล็กโทรไลต์ หรืออิเล็กโทรลิติกเซลล์ ประกอบด้วย ขั้วไฟฟ้า ภาชนะบรรจุสารละลายอิเล็กโทรไลต์ และเครื่องกำเนิดกระแสตรง (D.C) เช่น เซลล์ไฟฟ้า หรือ แบตเตอรี่
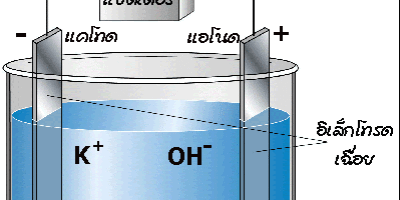
ภาพที่ 2 การทำงานของเซลล์อิเล็กโทรไลต์
ที่มา https://web.ku.ac.th/schoolnet/snet5/topic9/electrolite.html
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
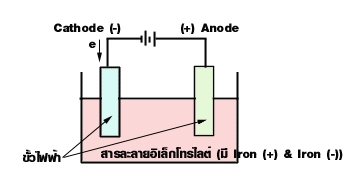
- ขั้วไฟฟ้า (Electrode) คือ แผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้วต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ โดยทั่วไปมักจะใช้ขั้วเฉื่อย เช่น ขั้ว Pt ขั้วไฟฟ้าแบ่งเป็นแอโนด และ แคโทด
สารละลายอิเล็กโทรไลต์ คือสารละลายที่นำไฟฟ้าได้ เพราะมี ไอออนบวก (+) และ ไอออนลบ (-) รวมอยู่ในสารละลายเดียวกัน
ขั้วแอโนด (Anode) เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน ซึ่งเป็นขั้วบวก (+) ที่ต่อเข้ากับขั้วบวกของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
ขั้วแคโทด (Cathode) เป็นขั้วที่เกิดปฏิกิริยารีดักชัน ซึ่งเป็นขั้วลบ (-) ที่ต่อเข้ากับขั้วลบของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
- สำหรับไอออนบวก (+) จะวิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชันจึงเรียกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคทไอออน (Cathion) ส่วนไอออนลบ (-) จะเป็นผู้ให้อิเล็กตรอน ที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชันเรียกว่าแอโนด และเรียก ไอออนลบ (-) ว่า แอนไอออน (Anion)
ดังนั้น ที่ Anode มี Anion คือ ไอออนลบ และที่ Cathode มี Cathion คือ ไอออนบวก ส่วน Anode (Oxidation) ตรงกับขั้วบวก Cathode (Reduction) ตรงกับขั้วลบ
แหล่งที่มา
บทเรียนออนไลน์. เซลล์ไฟฟ้าเคมี: เซลล์กัลวานิก และ เซลล์อิเล็กโทรไลต์. สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://www.scimath.org/lesson-chemistry/item/
สถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี. หนังสือแบบเรียนเคมีเพิ่มเติม เล่ม 4 ฉบับปรับปรุง พ.ศ. 2560. เซลล์ไฟฟ้าเคมี ศูนย์หนังสือจุฬาลงกรณ์มหาวิทยาลัย: กรุงเทพฯ
เอกสารประกอบคำบรรยาย วิชาเคมี ของโครงการส่งเสริมความสามารถพิเศษภาคฤดูร้อน Brands’s Summer Camp มหาวิทยาลัยเกษตรศาสตร์ . สืบค้นเมื่อ 20 ตุลาคม 2562. จาก https://web.ku.ac.th/schoolnet/snet5/topic9/galvanic.html/
อิเล็กทรอนิกส์เบื้องต้น: การต่อวงจรอิเล็กทรอนิกส์/ ไดโอด . สืบค้นเมื่อ 20 ตุลาคม 2562. จาก http://www.rmutphysics.com/