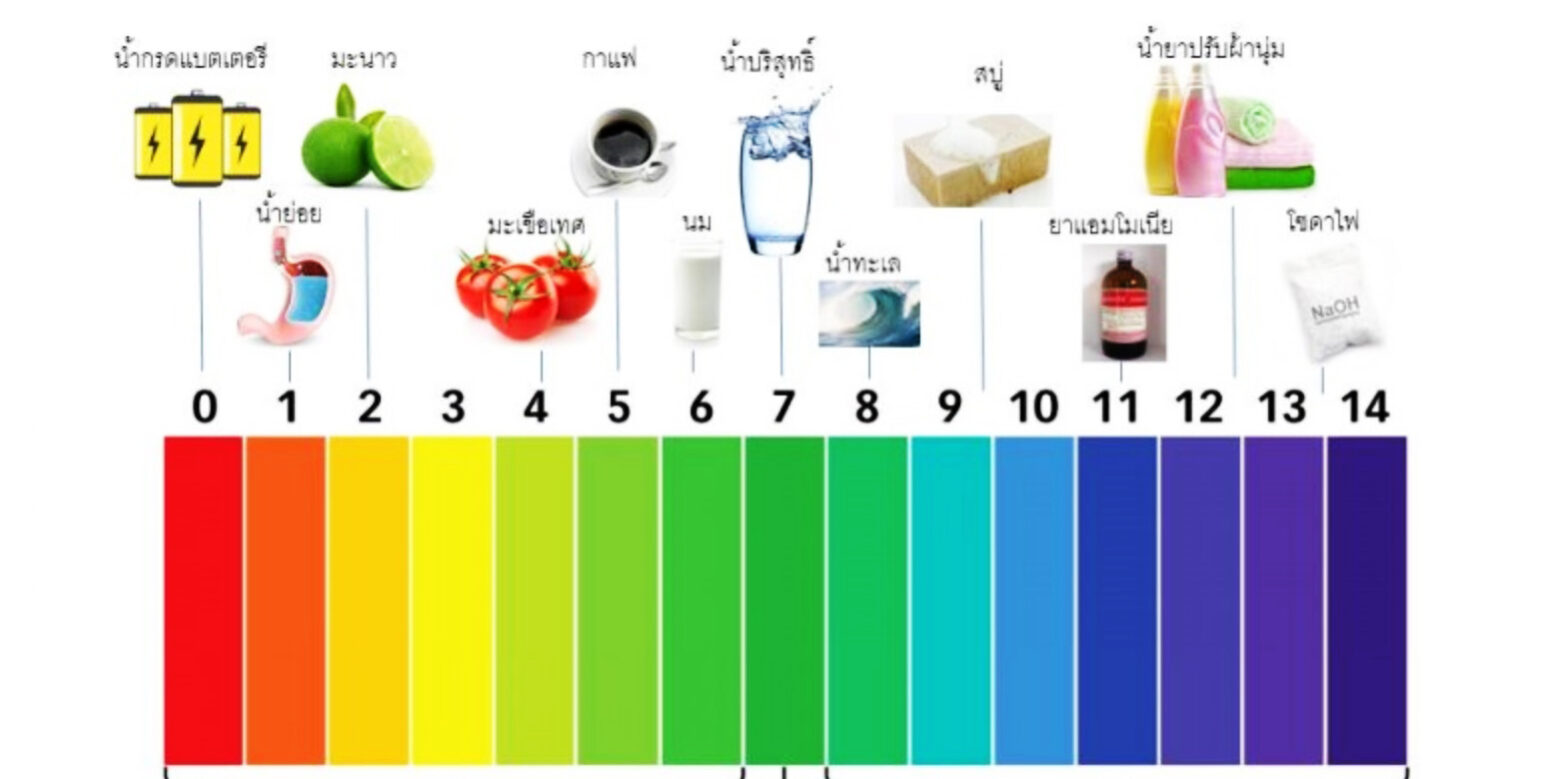
ค่า pH ของสารละลาย
pH = -log [H 3O +]
หรือ [H 3O] + = 10 -pH
โดยที่ [H 3O +] คือ ความเข้มข้นของ H 3O + หรือ H + เป็นโมล/ ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C จะมี [H 3O +] = 1 x 10 -7 โมล/ ลิตร
ดังนั้น pH = -log [H 3O +] = -log [1 x 10 -7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H 3O +] = 1 x 10 -5 ; pH = -log [H 3O +] = -log [1 x 10 -5] = 5 ( เป็นกรด)
ถ้า [H 3O +] = 1 x 10 -9 ; pH = -log [H 3O +] = -log [1 x 10 -9] = 9 ( เป็นเบส)
ดังนั้นสรุปว่า
- pH < 7 สารละลายเป็นกรด
- pH = 7 สารละลายเป็นกลาง
- pH > 7 สารละลายเป็นเบส
pOH ของสารละลาย คือ ค่าที่บอกความเข้มข้นของ OH – ในสารละลายมีค่าเท่ากับ –log[ OH -]
pOH = -log[ OH -]
โดย pH + pOH = 14
ตารางสเกล pH ของสารละลายที่มีความเข้มข้นต่างๆ กัน
|
[H 3O +] โมล/ ลิตร |
pH |
[ OH -] โมล/ ลิตร |
pOH |
|
1 x 10 0 1 x 10 -1 1 x 10 -2 1 x 10 -3 1 x 10 -4 1 x 10 -5 1 x 10 -6 1 x 10 -7 1 x 10 -8 1 x 10 -9 1 x 10 -10 1 x 10 -11 1 x 10 -12 1 x 10 -13 1 x 10 -14 |
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 |
1 x 10 -14 1 x 10 -13 1 x 10 -12 1 x 10 -11 1 x 10 -10 1 x 10 -9 1 x 10 -8 1 x 10 -7 1 x 10 -6 1 x 10 -5 1 x 10 -4 1 x 10 -3 1 x 10 -2 1 x 10 -1 1 x 10 0 |
14 13 12 11 10 9 8 7 6 5 4 3 2 1 0 |
วิธีวัด pH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสี วิธีนี้เป็นการวัด pH โดยประมาณ ( มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งได้เติมอินดิเคเตอร์ชนิดเดียวกันไปแล้ว หรือใช้กระดาษชุบอินดิเคเตอร์ ( กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์ วิธีนี้วัด pH ได้อย่างละเอียด ( มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว
วิธีที่นิยมและง่ายสุดคือทดสอบด้วยกระดาษลิตมัสจากการเปลี่ยนสี
สำหรับตัวเลขที่แสดงค่าพีเอช ถ้ามีค่าเท่ากับ 7 แสดงว่าสารนั้นเป็นกลางไม่มีฤทธิ์เป็นกรดหรือเบสถ้ามีค่าน้อยกว่า 7 แสดงว่าเป็นกรด และถ้ามากกว่า 7 แสดงว่าเป็นเบส
|
สาร |
pH |
|---|---|
|
กรดสารพิษจากเหมืองร้าง |
|
|
กรดจากแบตเตอรี |
|
|
กรดในกระเพาะอาหาร |
|
|
น้ำบริสุทธิ์ |
|
|
น้ำลายมนุษย์ |
|
|
แอมโมเนีย (ยาสามัญประจำบ้าน) |
|
สารในชีวิตประจำวันในสิ่งมีชีวิตมีค่าpHแตกต่างกันดังตารางต่อไปนี้
เราสามารถบอกความเป็นกรดเป็นเบสของสารละลายโดยค่า pH
pH ย่อมาจากคำว่า positive potential of the hydrogen ions คือ ค่าที่แสดงถึงความเข้มข้นของไฮโดรเจนไอออน (H+) หรือไฮโดรเนียมไอออน (H3O+) ใช้บอกความเป็นกรดหรือเบสของสารละลาย โดยค่า pH ของสารละลายเป็นค่า ลอการิทึมของความเข้มข้นของไฮโดรเจนไอออน
pH = -log [H3O+]
หรือ [H3O] + = 10-pH โดยที่ [H3O+] คือ ความเข้มข้นของ H3O+ หรือ H+ เป็นโมล/ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C จะมี [H3O+] = 1 x 10 -7 โมล/ลิตร
ดังนั้น pH = -log [H3O+] = -log [1 x 10 -7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H3O+] = 1 x 10 -5 ; pH = -log [H3O+] = -log [1 x 10 -5] = 5 (เป็นกรด)
ถ้า [H3O+] = 1 x 10 -9 ; pH = -log [H3O+] = -log [1 x 10 -9] = 9 (เป็นเบส)
ดังนั้นสรุปว่า
pH < 7 สารละลายเป็นกรด
pH = 7 สารละลายเป็นกลาง
pH > 7 สารละลายเป็นเบส
หรืออาจจะเขียนเป็นสเกลได้ดังนี้
หรือ [H3O] + = 10-pH โดยที่ [H3O+] คือ ความเข้มข้นของ H3O+ หรือ H+ เป็นโมล/ลิตร
น้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C จะมี [H3O+] = 1 x 10 -7 โมล/ลิตร
ดังนั้น pH = -log [H3O+] = -log [1 x 10 -7] = 7
นั่นคือ pH ของน้ำบริสุทธิ์ ที่อุณหภูมิ 25 0C เท่ากับ 7 ถือว่ามีสภาพเป็นกลาง คือไม่มีความเป็นกรดหรือเบส
ถ้า [H3O+] = 1 x 10 -5 ; pH = -log [H3O+] = -log [1 x 10 -5] = 5 (เป็นกรด)
ถ้า [H3O+] = 1 x 10 -9 ; pH = -log [H3O+] = -log [1 x 10 -9] = 9 (เป็นเบส)
ดังนั้นสรุปว่า
pH < 7 สารละลายเป็นกรด
pH = 7 สารละลายเป็นกลาง
pH > 7 สารละลายเป็นเบส
นอกจากจะบอกความเป็นกรดเป็นเบสของสารละลายด้วยค่า pH แล้วยังสามารถบอกค่าความเป็นกรด-เบส ได้โดยใช้ค่า pOHp ของสารละลาย คือ ค่าที่บอกความเข้มข้นของ OH–
pOH = -log[OH– ]
โดย pH + pOH = 14
ตารางแสดง สเกล pH ของสารละลายที่มีความเข้มข้นต่างๆ กัน
วิธีวัด pH ของสารละลายวัดได้ 2 วิธี ดังนี้
1. วิธีเปรียบเทียบสี วิธีนี้เป็นการวัด pH โดยประมาณ (มีความถูกต้อง 0.5 หน่วย pH) ซึ่งทำได้โดยเติมอินดิเคเตอร์ ที่เหมาะสมลงไปในสารละลายที่ต้องการวัด pH แล้วเปรียบเทียบกับสารละลาย ทำได้โดยเติมอินดิเคเตอร์ที่เหมาะสมลงไปใน สารละลายที่ต้องการวัด pH แล้วเปรียบเทียบสีกับสารละลายบัฟเฟอร์ที่ทราบค่า pH แน่นอน ซึ่งได้เติมอินดิเคเตอร์ชนิด เดียวกันไปแล้ว หรือใช้กระดาษชุบอินดิเคเตอร์ (กระดาษ pH) จุ่มลงไปแล้วเปรียบเทียบกับสีมาตรฐาน
2. วิธีวัดความต่างศักย์ วิธีนี้วัด pH ได้อย่างละเอียด (มีความถูกต้อง 0.01 หน่วย pH) โดยการใช้เครื่องมือที่เรียกว่า พีเอชมิเตอร์ ซึ่งวัด pH ของสารละลายได้โดยการวัดความต่างศักย์ระหว่างขั้วไฟฟ้า 2 ขั้ว
ตัวอย่างที่ 1ให้หาค่า pH ของสารละลายที่มี H3 O+ เท่ากับ 1 x 10 -11 และ 6 x 10 -14 โมล/ลิตร
วิธีทำ
[ H3 O+] = 1 x 10-11
pH = -log[ H3 O+] = -log[1 x 10-11 ] = 11
[ H3 O+] = 6 x 10-4
pH = -log[ H3 O+] = -log[6 x 10-4 ] = 4 – log6 = 4 – 0.78 = 3.22
ตัวอย่างที่ 2 จงหา pH ของสารละลายที่มีความเข้มข้นของ H3 O+ = 4.8 x 10-13โมล/ลิตร
วิธีทำ pH = -log[ H3 O+]
= -log[4.8 x 10-13]
= 13 – log 4.8
= 12.32
ตัวอย่างที่ 3 สารละลายชนิดหนึ่งมี pH = 4.00 จะมีความเข้มข้นของไฮโดรเนียมไอออนเป็นเท่าใด
วิธีทำ pH = -log[ H3 O+]
4 = -log[ H3 O+]
[ H3 O+] = 10-4
= 1 x 10-4
ตัวอย่างที่ 4 จงคำนวณหา [H+ ], [OH– ] , pH , และ pOH ของสารละลายที่มีกรดแก่ HX 0.01 โมลในน้ำ 500 cm3
วิธีทำ
กรดแก่ HX แตกตัวได้ 100 %
[HX] = 0.1 โมล/ลิตร = 0.02 โมล/ลิตร
HX ![]() H+ (aq) + X – (aq)
H+ (aq) + X – (aq)
0.02 โมล/ลิตร 0.02 โมล/ลิตร
เพราะฉะนั้น [H+] = 0.02 โมล/ลิตร
จาก [H+][OH– ] = 1 x 10-14 โมล/ลิตร
[OH– ] = = 5.0 x 10 –13
เพราะฉะนั้น [OH– ] = 5.0 x 10–13 โมล/ลิตร
pH = -log[H+] = -log(0.02) = 1.70
pH + pOH = 14
pOH = 14 – pH = 14 – 1.70 = 12.30