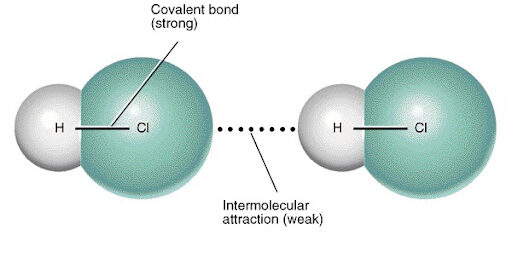
แรงระหว่างอะตอมหรือ โมเลกุลที่มีผลต่อจุดเดือด
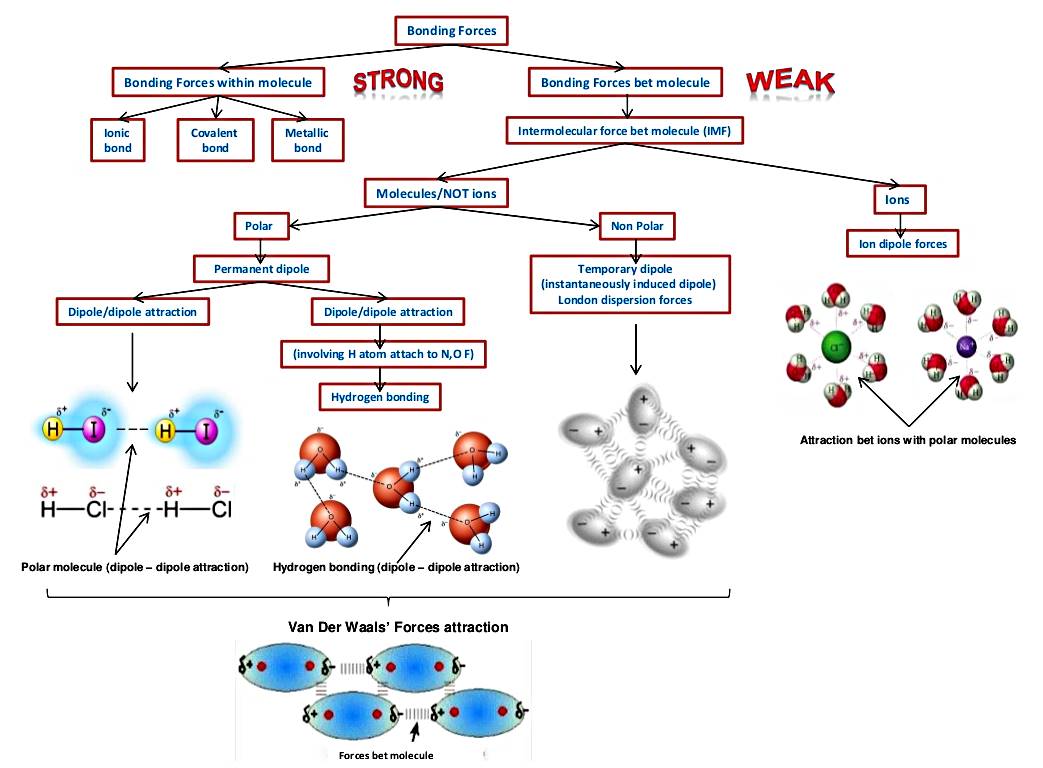
แผนผังแสดงระดับความแข็งแรงของแรงยึดเหนี่ยวระหว่างอะตอมและโมเลกุล
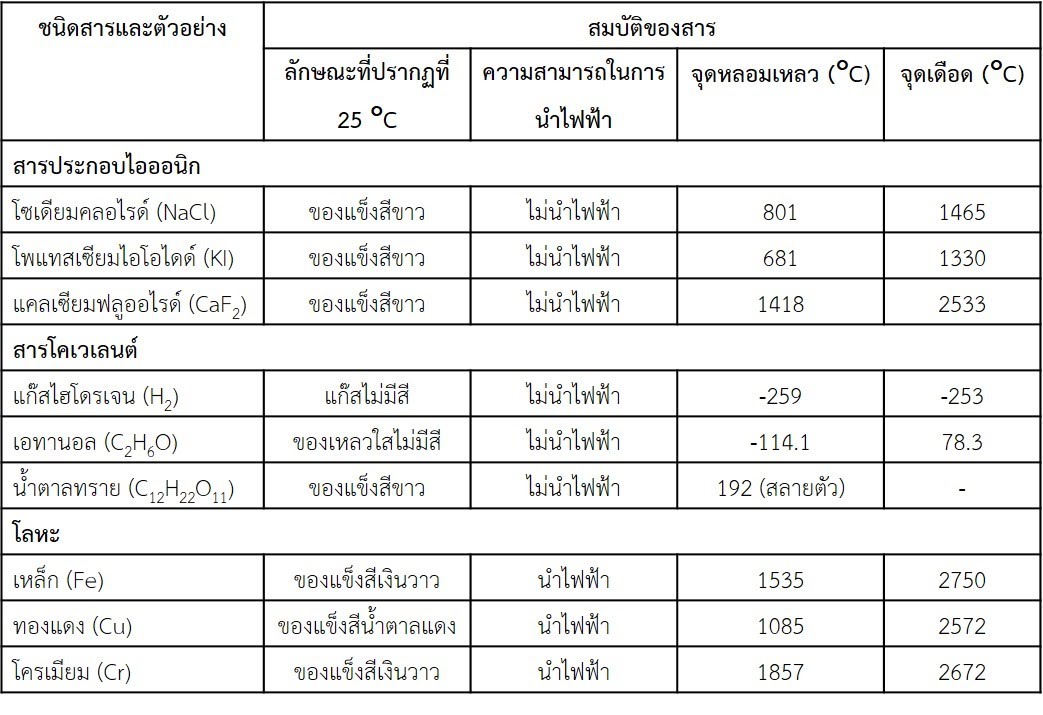
สารในกลุ่มโลหะ
พันธะโลหะ จุดเดือดสูงมาก (หลายร้อยองศาเซลเซียสจนถึงหลักพันองศาเซลเซียส) เนื่องจากเป็นแรงทางไฟฟ้า การทำลาย
พันธะต้องใช้พลังงานสูง โลหะส่วนใหญ่มีจุดเดือดและจุดหลอมเหลวสูงกว่าอุณหภูมิห้องหลายเท่าจึงมีสภาพเป็น
ของแข็ง ข้อยกเว้น ในปรอทที่มีจุดหลอมเหลวต่ำกว่าอุณหภูมิและจุดเดือดอยู่สูงกว่าอุณหภูมิ เราจึงมักเห็นปรอทมี
สถานะเป็นของเหลว
สารประกอบอิออนิก
พันธะอิออนิก จุดเดือดสูงมาก (มักเป็นหลักพันองศาเซลเซียส) เนื่องจากเป็นแรงทางไฟฟ้า การทำลายพันธะต้องใช้พลังงานสูง
สารประกอบอิออนิิกจึงมีสถานะเป็นของแข็งที่อุณหภูมิห้อง
สารประกอบโควาเลนต์
พันธะโควาเลนต์ ถูกทำลายยากเนื่องจากเป็นแรงภายในโมเลกุล จุดเดือดของสารโควาเลนต์จึงขึ้นอยู่กับแรงภายนอกโมเลกุล
(ไม่นับรวมสารในกลุ่มผลึกโครงร่างตาข่าย) ดังนี้
โมเลกุลมีขั้วสูง ที่มีตำแหน่ง -OH, -NH, =O สามารถสร้างพันธะไฮโดรเจนได้ จุดเดือดสูง (หลักร้อยองศาเซลเซียส)
โมเลกุลมีขั้วสูง ที่ใช้แรงไดโพล-ไดโพล หรืออิออน-ไดโพล ในการสร้างแรงยึดเหนี่ยวระหว่างโมเลกุล จุดเดือดสูง
โมเลกุลมีขั้วต่ำ จุดเดือดต่ำ
โมเลกุลไม่มีขั้ว จุดเดือดต่ำมาก บางชนิดอาจมีจุดเดือดต่ำกว่าอุณหภูมิห้อง (25 องศาเซลเซียส)
จากสิ่งที่กล่าวมาทำให้สารประกอบโควาเลนต์ส่วนใหญ่มีสถานะเป็นของเหลวและแก๊ส
ตัวอย่างจุดเดือดจุดหลอมเหลวของสารประกอบ