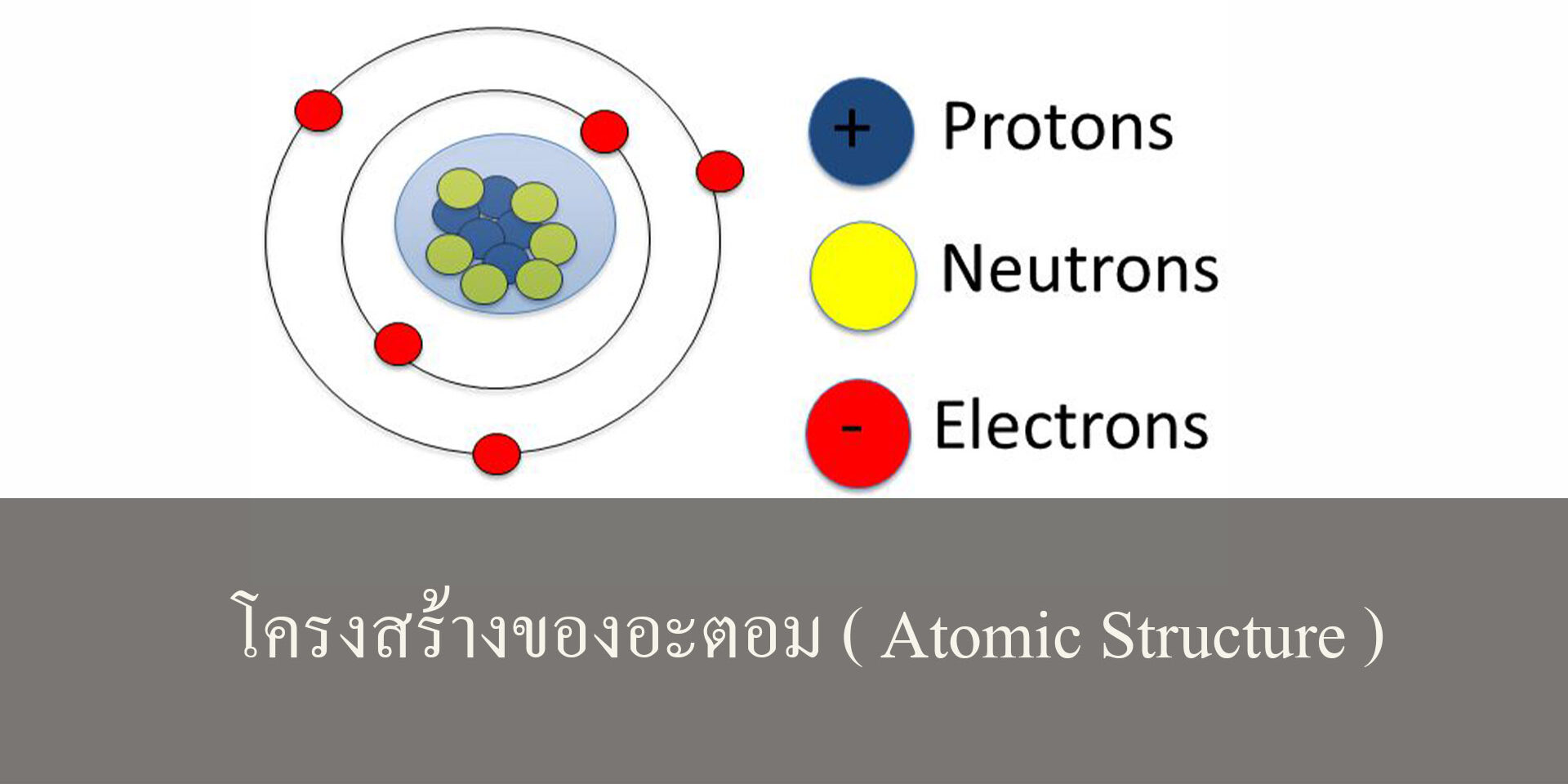
โครงสร้างของอะตอมจะมีนิวเคลียสอยู่ตรงกลางโดยนิวเคลียสจะประกอบด้วยโปรตอนและนิวตรอน โดยนิวเคลียสจะมีประจุเป็นบวก และมีอิเล็กตรอนเคลื่อนที่อยู่รอบๆนิวเคลียสโดยการเคลื่อนที่ของอิเล็กตรอนจะมีการเคลื่อนในหลายระดับพลังงานและ อิเล็กตรอนยังเคลื่อนที่สลับไปสลับมาระหว่างระดับพลังงานได้ด้วย
- แบบจำลองของจอห์น ดอลตัน จอห์น ดอลตันเป็นนักวิทยาศาสตร์ชาวอังกฤษ เสนอทฤษฏีของอะตอมโดยการทดลองได้ข้อสรุปที่ว่า สารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุด เรียกว่า อะตอม อะตอมนี้เป็นอนุภาคที่เล็กที่สุดและไม่สามารถแบ่งแยกได้อีก อะตอมของธาตุชนิดเดียวกันจะมีคุณสมบัติเหมือนกันทุกประการ ธาตุสามารถรวมตัวกันตั่งแต่สองตัวขึ้นไป การรวมตัวของธาตุเกิดเป็นสารประกอบ โดยอัตราการรวมตัวกันจะเป็นอัตราส่วนที่เป็นตัวเลขอย่างง่าย
- แบบจำลองของทอมสัน ทอมสันเป็นนักวิทยาศาสตร์ที่ทำการทดลองและค้นพบอิเล็กตรอนเป็นคนแรก และเป็นได้บอกว่าอะตอมมีลักษณะเป็นทรงกลม จากการที่ทอมสันค้นพบอิเล็กตรอนว่าเป็นส่วนประกอบของอะตอม จึงกล่าวว่าอะตอมไม่ใช่อนุภาคที่เล็กที่สุดแต่ อะตอมยังมีอนุภาคมูลฐานคือ อิเล็กตรอน โปรตอนและอนุภาคอื่นๆอีกด้วย อนุภาคของอิเล็กตรอนและโปรตอนจะกระจายตัวอย่างสม่ำเสมอภายในอะตอม และในอะตอมที่เป็นกลางจะมีอิเล็กตรอนที่มีค่าประจุไฟฟ้าเป็นลบ เท่ากับจำนวนโปรตอนที่มีค่าประจุไฟฟ้าเป็นบวก
- แบบจำลองอะตอมของรัทเทอร์ฟอร์ด รัทเทอร์ฟอร์ดได้กล่าวว่า อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนที่ค่าประจุบวกอยู่ตรงกลางของนิวเคลียส ทำให้นิวเคลียสมีประจุเป็นบวก และมีอิเล็กตรอนซึ่งมีค่าประจุเป็นลบเคลื่อนที่อยู่รอบรอบนิวเคลียส แต่จากการทดลองพบว่าน้ำหนักของนิวเคลียสที่ได้นั้นมากกว่าน้ำหนักของโปรตอนแสดงว่าในนิวเคลียสจะต้องมีอนุภาคชนิดอื่นอยู่ด้วย แต่อนุภาคชนิดนั้นจะไม่มีค่าประจุ เรียกว่ามีค่าประจุเป็นกลาง และมีมวลใกล้เคียงกับมวลของโปรตอนด้วย
- แบบจำลองของนิวส์โบร์ นีลส์โบร์ได้ศึกษาเกี่ยวกับการเรียงของอิเล็กตรอนในอะตอม โดยศึกษาเกี่ยวกับสเปกตรัมของอะตอม ทำให้ทราบว่าภายในอะตอมมีการจัดระดับพลังงานเป็นชั้นๆ และในแต่ละชั้นก็จะมีอิเล็กตรอนอาศัยอยู่ และได้ทำการศึกษาต่อเพื่อหาดูว่าในแต่ละชั้นนั้นมีอิเล็กตรอนอาศัยอยู่กี่ตัว จากการทดลองนีลส์โบร์ได้สรุปว่า อะตอมจะมีอิเล็กตรอนเคลื่อนที่รอบๆนิวเคลียสเป็นชั้นๆ แต่ละชั้นจะมีค่าพลังงานเฉพาะตัวที่แตกต่างกัน โดยอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีระดับพลังงานที่ต่ำที่สุด และอิเล็กตรอนที่อยู่ห่างจากนิวเคลียสมากขึ้นระดับพลังงานก็จะสูงขึ้นเรื่อยๆ โดยใช้สัญลักษณ์ว่า ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุด คือ n=1 ระดับพลังถัดไปคือ n=2,n=3,n=4 ,… หรือเรียกเป็นชั้นพลังงาน K,L, M, N ,O, P,…
- แบบจำลองกลุ่มหมอก หลังจากที่นิวส์โบได้เสนอแบบจำลองอะตอมขึ้นมาก็ได้มีการทดลองและประมวลต่อมาอีกจนได้แบบจำลองอะตอมที่เรียกว่ากลุ่มหมอก โดยจะกล่าวว่าการที่อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสด้วยรัศมีที่ไม่แน่นอน มีใกล้และไกลต่างกัน เราจึงไม่สามารถระบุตำแหน่งที่ชัดเจนของอิเล็กตรอนได้และอิเล็กตรอนก็เคลื่อนที่อย่างรวดเร็วจนเหมือนกับอิเล็กตรอนอยู่ทั่วไปหมด เราเรียกบริเวณที่อิเล็กตรอนเคลื่อนทีว่า “กลุ่มหมอก”
อะตอม เป็นโครงสร้างขนาดเล็กมากมองด้วยตาเปล่าไม่เห็น ที่พบได้ในสิ่งของทุก ๆ อย่างรอบตัวเรา อะตอมประกอบไปด้วยอนุภาค 3 ชนิด คือ: อิเล็กตรอน ซึ่งมีประจุลบโปรตอน ซึ่งมีประจุบวกนิวตรอน ซึ่งไม่มีประจุ
อิเล็กตรอน
อิเล็กตรอน (Electron) เป็นอนุภาค ที่มีประจุไฟฟ้า เป็นลบวิ่งอยู่รอบๆ นิวเคลียส โดยปกติ จำนวน อิเล็กตรอน ในอะตอมที่เป็นกลางทางไฟฟ้าจะมีเท่ากับจำนวน โปรตอน เช่น ไฮโดรเจน มีโปรตอน 1 ตัว และอิเล็กตรอน 1 ตัว ฮีเลียม มีโปรตอน 2 ตัว และอิเล็กตรอน 2 ตัว
โปรตรอน
โปรตรอน (Proton) คืออนุภาคที่มีประจุไฟฟ้าเป็นบวกอยู่ในนิวเคลียสหรือใจกลางของธาตุ ธาตุเดียวกันจะมีจำนวนโปรตอนเท่ากัน เช่นไฮโดรเจน เป็นธาตุตัวที่ 1 เบาที่สุดมีโปรตอนตัวเดียว โปรตอนเกิดจากควาร์ก up 2 และ down 1 มีประจุ +1.60×10^(-19)คูลอมบ์ มีน้ำหนัก 1.67×10^(-27) กิโลกรัม ฮีเลียม มี 2 ตัว เหล็กมี 26 ตัว ยูเรเนียม มี 92 ตัว
นิวตรอน
นิวตรอน (Neutron) เป็นอนุภาคที่เป็นกลางไม่มีประจุไฟฟ้าอยู่ในนิวเคลียสมีจำนวนใกล้เคียงกับโปรตอนแต่อาจแตกต่างกันได้เช่นในฮีเลียมมีนิวตรอน 2 ตัว เท่ากับโปรตอนแต่ในเหล็กมี 30 ตัว และในยูเรเนียมมีนิวตรอนถึง 146 ตัว นิวตรอนอาจเกิดจากการอัดอีเล็กตรอนกับโปรตอนดังเช่นในดาวฤกษ์มวลมาก นิวตรอนเกิดจากควาร์ก up 1 อนุภาค และ ควาร์ก down 2 อนุภาค มีน้ำหนัก 1.67×10^(-27)ซึ่งเท่ากันโปรตอน
อะตอมเป็นองค์ประกอบพื้นฐานทางเคมีซึ่งไม่เปลี่ยนแปลงตามปฏิกิริยาเคมี ธาตุที่พบได้ตามธรรมชาติบนโลกนี้นั้นมีปรากฏอยู่ประมาณ 90 ชนิดเท่านั้น (นอกเหนือจากนี้มี ธาตุบางชนิดเช่นเทคนิเซียม และ แคลิฟอร์เนียม ที่พบได้ในซูเปอร์โนวา และธาตุที่เลขอะตอม สูง (มากกว่า 100 ขึ้นไป) ที่สามารถสังเคราะห์ได้จาก การนำอะตอมมาชนกันด้วยความเร็วสูง)
เราเรียกอะตอม สองอะตอมว่าเป็นธาตุเดียวกันก็ต่อเมื่อ อะตอมสองอันนั้นมีจำนวนโปรตอนเท่ากัน โดยทั่วไปแล้ว ธาตุ แต่ละธาตุไม่เหมือนกัน อะตอมของธาตุชนิดเดียวกันอาจมีจำนวนนิวตรอนที่แตกต่างกัน เราเรียกสองอะตอมที่มีจำนวนโปรตรอนเท่ากันแต่จำนวนนิวตรอนแตกต่างกันนั้นจะเรียกว่าเป็นไอโซโทป (isotope)
นอกจากธาตุที่เกิดตามธรรมชาติแล้ว ยังมีธาตุที่ถูกสร้างขึ้น แต่ธาตุเหล่านี้มักจะไม่เสถียร และ สลายไปเป็นธาตุอื่นที่เสถียร โดยกระบวนการสลายกัมมันตรังสี ตัวอย่างเช่น Beta Decay ,Double Beta Decay , Beta Capture , Gamma Decay และอื่น ๆ
ถึงแม้ว่าจะมีธาตุที่เกิดตามธรรมชาติเพียง 90 ชนิด อะตอมของธาตุเหล่านี้สามารถสร้างพันธะทางเคมี รวมกันเป็นโมเลกุล และองค์ประกอบชนิดอื่นๆ โมเลกุลเกิดจากการรวมตัวกันของอะตอมหลายอะตอม เช่น โมเลกุลของน้ำเกิดจากการรวมตัวกันของอะตอมไฮโดรเจน 2 อะตอม และ อะตอมออกซิเจน 1 อะตอม
-ขอบคุณข้อมูล http://www.protoneurope.org/