เซลล์ไฟฟ้าเคมี แบ่งออกเป็น 2 ประเภทคือ
1. เซลล์กัลวานิก (galvanic cell) หรือเซลล์โวลตาอิก (voltaic cell)
2. เซลล์อิเล็กโทรไลต์ (electrolytic cell)
ได้กล่าวถึงปฏิกิริยารีดอกซ์ที่เกิดขึ้นเมื่อนำแผ่นสังกะสีจุ่มลงในสารละลายของทองแดง หรือตัวรีดิวซ์จุ่มลงในตัวออกซิไดซ์โดยตรงแล้วในบทนำ ปฏิกิริยาที่เกิดขึ้นทำให้เกิดพลังงานในรูปของความร้อน แต่ถ้าแยกตัวรีดิวซ์ออกจากตัวออกซิไดซ์ แล้วเชื่อมต่อวงจรภายนอกและสะพานเกลือ (salt bridge) อิเล็กตรอนก็จะถูกถ่ายโอนผ่านตัวกลางภายนอกจากขั้วไฟฟ้าที่เกิดปฏิกิริยาออกซิเดชันไปยังขั้วไฟฟ้าที่เกิดปฏิกิริยารีดักชัน จึงทำให้เกิดกระแสไฟฟ้าได้ เซลล์ไฟฟ้าที่เกิดจากปฏิกิริยาเคมีนี้เรียกว่าเซลล์กัลวานิก หรือเซลล์โวลตาอิก (galvanic cell or voltaic cell) ดังรูป

จากรูปเซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด (electrode) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด (anode) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่าขั้วแคโทด (cathode)
ปฏิกิริยาออกซิเดชันที่แอโนด (Zn) Zn(s) ![]() Zn2+(aq) + 2e–
Zn2+(aq) + 2e–
ปฏิกิริยารีดักชันที่แคโทด (Cu) Cu2+(aq) + 2e– ![]() Cu(s)
Cu(s)
หมายเหตุ : ประจุที่สะสมจะทำให้ออกซิเดชันที่แคโทดและรีดักชันที่แอโนดเกิดยากขึ้น
ระหว่างที่เกิดปฏิกิริยาออกซิเดชันขึ้นที่ขั้วแอโนด Zn จะค่อย ๆ กร่อนแล้วเกิดเป็น Zn2+ ละลายลงมาในสารละลายที่มี Zn2+ และ SO42- ส่วนที่ขั้วแคโทด Cu2+จากสารละลายเกิดปฏิกิริยารีดักชันกลายเป็นอะตอมของทองแดงเกาะอยู่ที่ผิวของขั้วไฟฟ้า เมื่อปฏิกิริยาดำเนินไปจะพบว่าในครึ่งเซลล์ออกซิเดชันสารละลายจะมีประจุบวก (Zn2+) มากกว่าประจุลบ (SO42-) และในครึ่งเซลล์รีดักชันสารละลายจะมีประจุลบ (SO42-) มากกว่าประจุบวก (Cu2+) จึงเกิดความไม่สมดุลทางไฟฟ้าขึ้น ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้ สะพานเกลือ (salt bridge) เชื่อมต่อระหว่างสองครึ่งเซลล์ ซึ่งสะพานเกลือทำจากหลอดแก้วรูปตัวยู ภายในบรรจุอิเล็กโตรไลต์ที่ไม่ทำปฏิกิริยากับสารในเซลล์และมีไอออนบวก ไอออนลบเคลื่อนที่ด้วยความเร็วใกล้เคียงกัน หรือทำจากกระดาษกรองชุบอิเล็กโตรไลต์ โดยสะพานเกลือทำหน้าที่เป็นตัวกลางที่เชื่อมต่อระหว่างครึ่งเซลล์ทั้งสอง และเป็นสิ่งที่ป้องกันการเกิดการสะสมของประจุโดยไอออนบวกจากสะพานเกลือจะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุลบมาก ในทางตรงกันข้ามไอออนลบก็จะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุมาก จึงทำให้ปฏิกิริยาดำเนินต่อไปได้ในเวลาที่มากขึ้น
และเนื่องจากครึ่งเซลล์ทั้งสองเชื่อมต่อกับวงจรภายนอก ครึ่งเซลล์ที่มีศักย์รีดักชันสูงกว่าจะเกิดรีดักชัน และครึ่งเซลล์ที่มีศักย์รีดักชันต่ำกว่าจะ(ถูกบังคับให้)เกิดออกซิเดชัน ความต่างศักย์ระหว่างอิเล็กโทรดนี้ เรียกว่า แรงเคลื่อนไฟฟ้า (electromotive force: emf) และมีหน่วยเป็นโวลต์ (volt)
เมื่อเรียนเรื่องเซลล์กัลวานิก เราก็จำเป็นที่จะต้องทำความเข้าใจเกี่ยวกับเรื่องต่อไปนี้
1. ศักย์อิเล็กโทรดมาตรฐาน
2. ค่าศักย์รีดักชันมาตรฐานกับตารางธาตุ
3. แผนภาพเซลล์กัลวานิก
สมบัติของสารที่ใช้ทำเป็นสะพานไอออน
1. เป็นสารประกอบไอออนิกที่สามารถแตกตัวละลายน้ำได้ดี มีปริมาณไอออนมาก
2. ไอออนต้องไม่ทำทำปฏิกิริยาเคมีใดๆ กับสารละลายของแต่ละครึ่งเซลล์
3. ไอออนบวกและไอออนลบที่แตกตัวออกมาต้องมีความสามารถในการเคลื่อนที่ใกล้เคียงกัน
4. สารที่ใช้ทำสะพานไอออน ได้แก่ KNO3, KCl, NH4Cl
5. ต้องเป็นสารละลายอิ่มตัว ประกอบด้วยไอออนมาก
ลักษณะสำคัญของเซลล์กัลวานิก
1. กระแสไฟฟ้าที่เกิดขึ้นเป็นกระแสตรง คือ กระแสอิเล็กตรอน
2. อิเล็กตรอนจะไหลจากครึ่งเซลล์ที่มีศักย์ไฟฟ้าต่ำไปยังครึ่งเซลล์ที่มีศักย์ไฟฟ้าสูง
เซลล์อิเล็กโทรไลต์ (Electrolytic cell)
เซลล์อิเล็กโทรไลต์ คือ เซลล์ไฟฟ้าเคมีที่ใช้พลังงานไฟฟ้าให้เปลี่ยนเป็นพลังงานเคมี หรือเกิดปฏิกิริยาเคมีขึ้น นั่นเอง
ปฏิกิริยาที่เกิดขึ้นก็จะเป็นปฏิกิริยารีดอกซ์ ซึ่งเซลล์ประเภทนี้จะมีค่า E0 cell ติดลบ
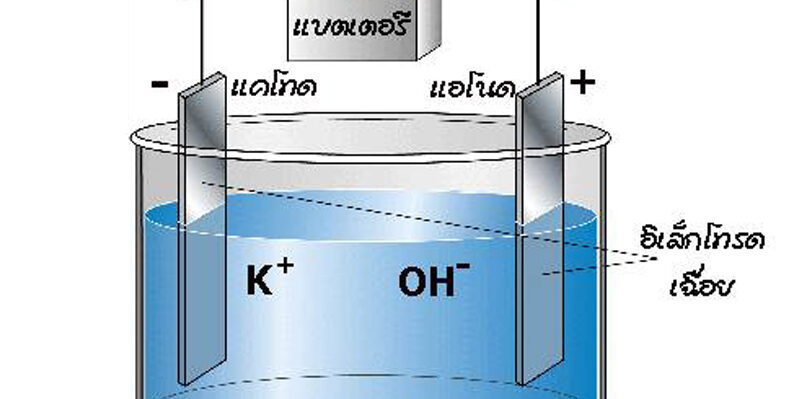
เซลล์อิเล็กโทรไลต์ประกอบด้วยภาชนะที่บรรจุสารเคมีที่จะเกิดปฏิกิริยา และมีขั้วไฟฟ้าซึ่งต่ออยู่กับแหล่งไฟฟ้ากระแสตรง โดยทั่วไปมักเป็นขั้วเฉื่อยที่ไม่มีส่วนร่วมกับปฏิกิริยา
สารละลายโพแทสเซียมไฮดรอกไซด์เป็นสารละลายอิเล็กโทรไลต์ ขณะที่ผ่านไฟฟ้ากระแสตรงเข้าไป ไอออนบวก (Cation) จะเคลื่อนที่ไปยังขั้วลบ (แคโทด) และไอออนลบ (Anion) จะเคลื่อนที่ไปยังขั้วบวก (แอโนด) เพื่อให้อิเล็กตรอนถูกออกซิไดส์
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
1. ขั้วไฟฟ้า(Electrode) เป็นโลหะหรือแกรไฟต์ที่นำไฟฟ้าได้ดี โดยทั่วไปมักจะใช้ขั้วเฉื่อย เช่น ขั้ว Pt สามารถจำแนกขั้วไฟฟ้าได้ดังนี้
จำแนกตามการเกิดปฏิกิริยา
1.1 ขั้วแอโนด (Anode) เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน
1.2 ขั้วแคโทด (Cathode) เป็นขั้วที่เกิดปฏิกิริยารีดักชัน
จำแนกขั้วตามการต่อเข้ากับแหล่งกำเนิดไฟฟ้า
1.1 ขั้วบวก เป็นขั้วที่ต่อเข้ากับขั้วบวกของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
1.2 ขั้วลบ เป็นขั้วที่ต่อเข้ากับขั้วลบของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
2. สารอิเล็กโทรไลต์ คือ สารที่มีสถานะของเหลวประกอบด้วยไอออนที่เคลื่อนที่ และนำไฟฟ้าได้
2.1 สารประกอบไอออนิกหลอมเหลว เช่น สารละลายโซเดียมคลอไรด์ที่หลอมเหลว
2.2 สารละลายอิเล็กโทรไลต์ เช่น สารละลายกรด เบส เกลือ