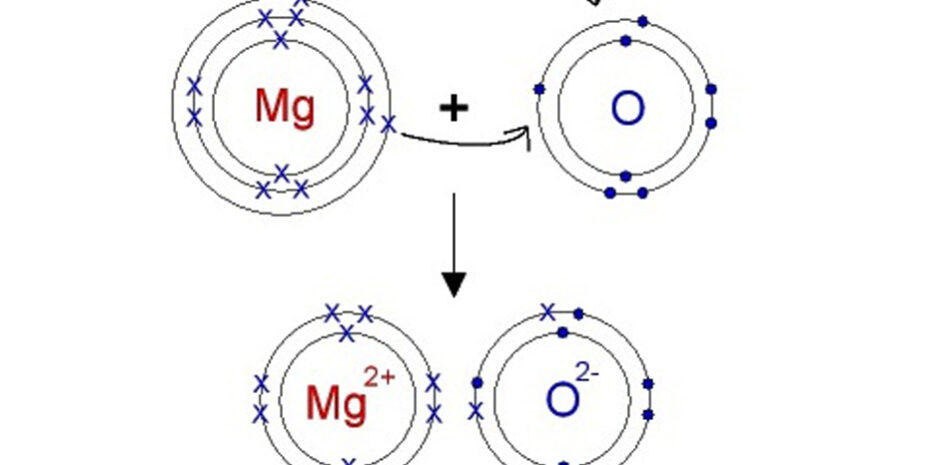
การเขียนสูตรสารประกอบไอออนิก ใช้หลักดังนี้
1. เขียนไอออนบวกของโลหะหรือกลุ่มไอออนบวกไว้ข้างหน้า ตามด้วยไอออนลบของอโลหะหรือกลุ่มไอออนลบ
2. ไอออนบวกและไอออนลบ จะรวมกันในอัตราส่วนที่ทำให้ผลรวมของประจุเป็นศูนย์ ดังนั้นจึงต้องหาตัวเลขมาคูณกับจำนวนประจุบนไอออนบวกและไอออนลบให้มีจำนวนเท่ากัน แล้วใส่ตัวเลขเหล่านั้นไว้ที่มุมขวาล่างของแต่ละไอออน ซึ่งทำได้โดยใช้จำนวนประจุบนไอออนบวกและไอออนลบคูณไขว้กัน
3. ถ้ากลุ่มไอออนบวกหรือไอออนลบมีมากกว่า 1 กลุ่ม ให้ใส่วงเล็บ ( ) และใส่จำนวนกลุ่มไว้ที่มุมล่างขวาล่าง ดังตัวอย่าง
จงเขียนสูตรของสารประกอบไอออนิกต่อไปนี้ ก. Na+ กับ O2- ข. Ca2+ กับ Cl– ค. NH4+ กับ SO42-
การอ่านชื่อสารประกอบไอออนิก
1. สารประกอบธาตุคู่ ถ้าสารประกอบเกิดจาก ธาตุโลหะที่มีไอออนได้ชนิดเดียวรวมกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวก แล้วตามด้วยชื่อธาตุอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น
|
อออซิเจน เปลี่ยนเป็น ออกไซด์ (oxide) |
ไฮโดรเจน เปลี่ยนเป็น ไฮไดรด์ (hydride) |
| คลอรีน เปลี่ยนเป็น คลอไรด์ (chloride) | ไอโอดีน เปลี่ยนเป็น ไอโอไดด์ (iodide) |
ตัวอย่างการอ่านชื่อสารประกอบไอออนิกธาตุคู่
| NaCl อ่านว่า โซเดียมคลอไรด์ (Sodium chloridr) | CaI2 อ่านว่า แคลเซียมไอโอไดด์ (Calcium iodide) |
| KBr อ่านว่า โพแทสเซียมโบรไมด์ (Potascium bromide) | CaCl2 อ่านว่า แคลเซียมคลอไรด์ (Calcium chloride) |
ถ้าสารประกอบที่เกิดจากธาตุโลหะเดีนวกันที่มีไอออนได้หลายชนิด รวมตัวกับอโลหะ ให้อ่านชื่อโลหะที่เป็นไอออนบวกแล้วตามด้วยค่าประจุของไอออนของโลหะโดยวงเล็บเป็นเลขโรมัน แล้วตามด้วยอโลหะที่เป็นไอออนลบ โดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ (ide) เช่น Fe เกิดไอออนได้ 2 ชนิดคือ Fe 2+ และ Fe 3+ และCu เกิดอิออนได้ 2 ชนิดคือ Cu + และ Cu 2+ สารประกอบที่เกิดขึ้นและการอ่านชื่อ ดังนี้
| FeCl2 อ่านว่า ไอร์ออน (II) คลอไรด์ ( Iron (II) chloride ) | CuS อ่านว่า คอปเปอร์ (I) ซัลไฟด์ ( Cupper (I) sunfide ) |
| FeCl3 อ่านว่า ไอร์ออน (III) คลอไรด์ ( Iron (III) chloride ) | Cu2S อ่านว่า คอปเปอร์ (II) ซัลไฟด์ ( Copper (II) sunfide ) |
2. สารประกอบธาตุสามหรือมากกว่า ถ้าสารประกอบเกิดจากไอออนบวกของโลหะ หรือกลุ่มไอออนบวกรวมตัวกับกลุ่มไอออนลบ ให้อ่านชื่อไอออนบวกของโลหะหรือชื่อกลุ่มไอออนบวก แล้วตามด้วยกลุ่มไอออนลบ เช่น
| CaCO3 อ่านว่า แคลเซียมคาร์บอนเนต (Calcium carbonatX | KNO3 อ่านว่า โพแทสเซียมไนเตรต (Potascium nitrae) |
| Ba(OH)2 อ่านว่า แบเรียมไฮดรอกไซด์ (Barium hydroxide) | (NH4)3PO4 อ่านว่า แอมโมเนียมฟอสเฟต (Ammomium pospate) |
สรุปหลักการเรียกชื่อสารประกอบไอออนิก
- เรียกชื่อไอออนบวกตามด้วยไอออนลบ
- เรียกไออนบวกที่เป็นไอออนของอะตอมเดี่ยวตามชื่อของธาตุนั้น เช่น Ca2+ อ่านว่า แคลเซียม
Na+ อ่านว่า โซเดียม Al3+ อ่านว่า อลูมิเนียม H+ อ่านว่า ไฮโดรเจน Ag+ อ่านว่า ซิลเวอร์ เป็นต้น
- ไอออนบวกของโลหะทรานสิชันที่มีเลขออกซิเดชันหลายค่า จะเขียนชื่อธาตุ ตามด้วยเลขออกซิเดชันเป็นเลขโรมันในเครื่องหมายวงเล็บ และให้เรียกชื่อด้วยภาษากรีก ( ถ้ามี ) แล้วลงท้ายไอออนที่มีเลขออกซิเดชันมากด้วย “อิก ( – ic )” และลงท้ายไอออนที่มีเลขออกซิเดชันน้อยด้วย “อัส ( – ous )” เช่น
ตัวอย่างที่ 1
Fe มีชื่อภาษากรีก คือ เฟอร์รัม ( Ferrum ) มีเลขออกซิเดชัน 2 ค่า คือ +2 และ +3
Fe (II) หรือ iron (II) เรียกว่า เฟอร์รัส ( ferrous )
ส่วน Fe (III) หรือ iron (III) เรียกว่า เฟอร์ริก ( ferric )
ตัวอย่างที่ 2
Hg มีเลขออกซิเดชัน 2 ค่า คือ +1 และ +2
Hg (I) หรือ mercury (I) เรียกว่า เมอร์คิวรัส ( mercurous )
ส่วน Hg (II) หรือ mercury (II) เรียกว่า เมอร์คิวริก ( mercurous )
- เรียกไอออนบวกที่มาจากกลุ่มอะตอมหรือโมเลกุลคล้ายชื่อเดิม แต่งท้ายสียงด้วย “เนียม ( – nium )” เช่น NH4+ เรียกว่า แอมโมเนียม PH4+ เรียกว่า ฟอสโฟเนียม เป็นต้น
- ไอออนลบส่วนใหญ่เรียกชื่อโดยเปลี่ยนท้ายชื่อภาษาอังกฤษเป็น “-ไอด์ ( – ide )” หรือบางชนิดเป็น “ –เอต ( – ate )” ตัวอย่างเช่น
H– เรียกว่า ไฮไดรด์ / hydride F– เรียกว่า ฟลูออไรด์ / fluoride
Cl– เรียกว่า คลอไรด์ / Chloride Br– เรียกว่า โบรไมด์ / bromide
I– เรียกว่า ไอโอไดด์ / iodide P 3- เรียกว่า ฟอสไฟด์ / phosphide
SCN– เรียกว่า ไทโอไซยาเนต / thiocyanate NO3– เรียกว่า ไนเทรต / nitrate
NCS– เรียกว่า ไอโซไทโอไซยาเนต / isothiocyanate NO2– เรียกว่า ไนไทรต์ / nitrite
ตัวอย่างการเรียกชื่อสารประกอบไอออนิกบางชนิด
NaCl โซเดียมคลอไรด์
BaBr2 แบเรียมโบรไมด์
KMnO4 โพแทสเซียมเปอร์แมงกาเนต
CaC2O4 แคลเซียมออกซาเลต
NaHCO3 โซเดียมไฮโดรเจนคาร์บอเนต หรือ โซเดียมไบคาร์บอเนต
(NH4)2SO4 แอมโมเนียมซัลเฟต
Co (NO3)3 โคบอลต์ (III) ไนเทรต
Co (NO3)2 โคบอลต์ (II) ไนเทรต
Fe2O3 เฟอร์ริกออกไซด์ หรือ เหล็ก (III) ออกไซด์
ขอบคุณข้อมูล https://www.scimath.org/