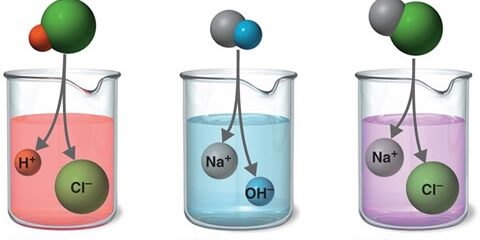
ปฏิกิริยากรด-เบส
กรด – เบส
กรด – เบส คืออะไร
กรด เบส ในชีวิตประจำวัน ( Acid Base in Everyday Life)
สารประกอบจำพวกกรด เบส มีความสำคัญและเกี่ยวข้องกับชีวิตประจำวันของมนุษย์อย่างมาก ก่อนอื่นต้องทำความเข้าใจว่า กรด เบส คืออะไรอย่างง่ายๆ
สารละลายกรด คือสารละลายที่มีรสเปรี้ยว เปลี่ยนสีกระดาษลิตมัสจากน้ำเงินเป็นแดง หรือทำปฏิกิริยากับโลหะได้ แก๊ส H 2 และ เกลือ
สารละลายเบส คือสารละลายที่มีรสขม เปลี่ยนสีกระดาษลิตมัสจากแดงเป็นน้ำเงิน หรือมีลักษณะลื่นๆ
นิยามของกรด-เบส Arrhenius Concept
กรด คือ สารประกอบที่มี H และเมื่อละลายน้ำจะแตกตัวให้ H + หรือ H 3O +
เบส คือ สารประกอบที่มี OH และเมื่อละลายน้ำจะแตกตัวให้ OH –
ข้อจำกัดของทฤษฎีนี้คือ สารประกอบต้องละลายได้ในน้ำ และไม่สามารถอธิบายได้ว่า ทำไมสารประกอบบางชนิดเช่น NH 3 จึงเป็นเบส
Bronsted-Lowry Concept
กรด คือ สารที่สามารถให้โปรตอน ( proton donor)แก่สารอื่น
เบส คือ สารที่สามารถรับโปรตอน ( proton acceptor)จากสารอื่น
ปฏิกิริยาระหว่างกรดกับเบสจึงเป็นการถ่ายเทโปรตอนจากกรดไปยังเบสเช่น แอมโมเนียละลายในน้ำ
NH 3(aq) + H 2O (1)
NH 4 + (aq) + OH – (aq)
base 2 …….. acid 1 …….. acid 2 …….. base 1
ในปฏิกิริยาไปข้างหน้า NH 3 จะเป็นฝ่ายรับโปรตอนจาก H 2O ดังนั้น NH 3 จึงเป็นเบสและ H 2O เป็นกรด แต่ในปฏิกิริยาย้อนกลับ NH 4 + จะเป็นฝ่ายให้โปรตอนแก่ OH – ดังนั้น NH 4 + จึงเป็นกรดและ OH – เป็นเบส อาจสรุปได้ว่าทิศทางของปฏิกิริยาจะขึ้นอยู่กับความแรงของเบส
Lewis Concept
กรด คือ สารที่สามารถรับอิเลคตรอนคู่โดดเดี่ยว ( electron pair acceptor) จากสารอื่น
เบส คือ สารที่สามารถให้อิเลคตรอนคู่โดดเดี่ยว ( electron pair donor)แกสารอื่น
ทฤษฎีนี้ใช้อธิบาย กรด เบส ตาม concept ของ Arrhenius และ Bronsted-Lowry ได้ และมีข้อได้เปรียบคือสามารถอธิบาย กรด เบส ในกรณีที่เกิดปฏิกิริยาระหว่างกัน และได้สารประกอบที่มีพันธะโควาเลนซ์ เช่น
OH – (aq) + CO 2 (aq)  HCO 3 – (aq)
HCO 3 – (aq)
BF 3 + NH 3 BF 3-NH 3
BF 3-NH 3
คู่กรด – เบส
คู่กรด – เบส คือ สารที่เป็นคู่กรด-เบสกัน H + ต่างกัน 1 ตัว โดยที่ คู่กรดจะมี H + มากกว่าคู่เบส 1 ตัว
ความแรงของกรดและเบส = การแตกตัวในการให้โปรตอน(กรด) ความสามารถในการรับโปรตอน(เบส)
CH 3COOH (aq) + H 2O (aq)  CH 3COO – (aq) + H 3O + (aq)
CH 3COO – (aq) + H 3O + (aq)
<<< เราต้องรู้ทิศทางการเลื่อนของสมดุลก่อน เราจึงจะบอกถึงความแรงได้>>>
1. ถ้าสมดุลเลื่อนไปทางขวา CH 3COOH เป็นกรดแรงกว่า H 3O + / H 2O เป็นเบสแรงกว่า CH 3COO –
2. ถ้าสมดุลเลื่อนไปทางซ้าย H 3O + เป็นกรดแรงกว่า CH 3COOH / CH 3COO – เป็นเบสแรงกว่า H 2O
ถ้าค่า K > 1 สมดุลเลื่อนไปข้างหน้า(สารผลิตภัณฑ์มากกว่าสารตั้งต้น)
K < 1 สมดุลเลื่อนย้อนกลับ(สารผลิตภัณฑ์น้อยกว่าสารตั้งต้น)
K = 1 ไปข้างหน้าเท่ากับย้อนกลับ (สารผลิตภัณฑ์=สารตั้งต้น) ความแรงทั้ง 2 ข้างเท่ากัน
เปรียบเทียบกรดแก่กับเบสแก่
กรดแก่ |
เบสแก่ |
1. กรดแก่มีอะไรบ้าง
|
1. เบสแก่มีอะไรบ้าง
|
กรดแก่ ( strong acid)
คือกรดที่สามารถแตกตัวได้ 100% ในน้ำ เช่น HCl H2SO4 HN03 HBr HClO4 และ HI
เบสแก่ ( weak base)
คือกรดที่สามารถแตกตัวได้ 100% ในน้ำ เช่น Hydroxide ของธาตุหมู่ 1 และ 2 ( NaOH LiOH CsOH Ba(OH) 2 Ca(OH) 2 )
กรดอ่อน ( weak acid)
คือกรดที่สามารถแตกตัวเป็นไอออนได้เพียงบางส่วน เช่น กรดอะซิติคในน้ำส้มสายชู (vinegar) ยาแอสไพริน (acetylsalicylic acid) ใช้บรรเทาอาการปวดศรีษะ saccharin เป็นสารเพิ่มความหวาน niacin (nicotinic acid) หรือ ไวตามินบี เป็นต้น ตัวอย่างปฏิกิริยาของสารละลายกรด CH 3COOH ในส่วนผสมของน้ำส้มสายชูจะมีดังนี้ :
CH 3COOH (aq) + H2O (1) H3O + (aq) + CH3COO – (aq) มีค่า K a
H3O + (aq) + CH3COO – (aq) มีค่า K a
เบสอ่อน (weak base) คือเบสที่สามารถแตกตัวเป็นไออนได้เพียงบางส่วน เช่น NH 3 urea aniline เป็นต้น ตัวอย่างปฏิกิริยาของ ammonia มีดังนี้
NH3(aq) + H2O (aq) NH4 + (aq) + OH – (aq)
NH4 + (aq) + OH – (aq)
ชนิดของกรดและเบส
กรด แบ่งตามการแตกตัว แบ่งได้ 3 ชนิด
1. กรด Monoprotic แตกตัว 1 ได้แก่ HNO 3 , HClO 3 , HClO 4 , HCN
2. กรด Diprotic แตกตัว 2 ได้แก่ H 2SO 4 , H 2CO 3
3. กรดPolyprotic แตกตัว 3 ได้แก่ H 3PO 4
การแตกตัวของกรด Polyprotic แต่ละครั้งจะให้ H + ไม่เท่ากัน แตกครั้งแรกจะแตกได้ดีมาก ค่า Ka สูงมากแต่แตกครั้งต่อ ๆ ไปจะมีค่า Ka ต่ำมาก เพราะประจุลบในไอออนดึงดูด H + ไว้ดังสมการ
H 2SO 4  H+ + HSO 4 – Ka 1 = 10 11
H+ + HSO 4 – Ka 1 = 10 11
HSO 4 –  H+ + SO 4 2- Ka 2 = 1.2 x 10 -2
H+ + SO 4 2- Ka 2 = 1.2 x 10 -2
เนื่องมาจากกรด Polyprotic มักมีค่า K 1 >> K 2 >> K 3 H + ในสารละลายส่วนใหญ่จะได้มาจากการแตกตัวครั้งแรก
ถ้าค่า K 1 มากกว่า K 2 =10 3 เท่าขึ้นไปจะพิจารณาค่า pH ของสารละลายกรด Polyprotic ได้จากค่า K 1 เท่านั้น แต่ถ้าค่า K 2 มีค่าไม่ต่ำมาก จะต้องนำค่า K 2 มาพิจารณาด้วย
เบส แบ่งตาม จำนวน OH – ในเบส แบ่งได้เป็น 3 ชนิด คือ
1. เบสที่มี OH – ตัวเดียว เช่น LiOH NaOH KOH RbOH CsOH
2. เบสที่มี OH – 2 ตัว เช่น Ca(OH) 2 Sr(OH) 2 Ba(OH) 2
3. เบสที่มี OH – 3 ตัว เช่น Al(OH) 3 Fe(OH) 3
รวมสูตรที่ใช้คำนวณในกรณีหา กรดอ่อน เบสอ่อน ไม่ผสมกัน
สูตรที่ |
กรณี (ต้องการหาอะไร) |
กรดอ่อน |
เบสอ่อน |
1. |
หาค่า K |
Ka = [H +] 2 /N |
Kb = [ OH -] 2 /N |
2. |
หา [ H +] |
[H +] = [Ka.N]^1/2 |
[ OH -] = [Kb.N]^1/2 |
3. |
หา % การแตกตัว |
% การแตกตัว = [H +] x 100 / N |
% การแตกตัว = [ OH -] x 100 / N |
4. |
การรวมสูตรของ % กับ K |
% = Ka x 100 / N |
% = Kb x 100 / N |
ปฏิกิริยาของกรด – เบส
ปฏิกิริยาของกรด เบส แบ่งได้เป็น 4 ชนิดคือ
-
-
ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
-
ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
-
ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
-
ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
-
การแตกตัวของน้ำและค่า pH ของสารละลาย
น้ำบริสุทธิ์จัดเป็นตัวทำละลายที่สำคัญ เป็นพวก นอน-อิเลคโตรไลท์ (nonelectrolyte) หรือไม่สามารถนำไฟฟ้า แต่จากการทดลองพบว่า น้ำบริสุทธิ์นำไฟฟ้าได้บ้างเล็กน้อย ทั้งนี้เพราะว่าน้ำสามารถแตกตัวได้เอง ซึ่งเรียกว่า self-ionization หรือ autoprotolysis
H 2O (1) + H 2O (1)  H 3O + (aq) + OH -(aq)
H 3O + (aq) + OH -(aq)
…. acid 1 …..base 2 ………….acid 2 ……..base 1
หรือ 2H 2O (1) = H 3O + (aq) + OH – (aq)
จากความสัมพันธ์ของ K w ในปฏิกิริยาการแตกตัวของน้ำ
K w = [H 3O +][ OH -] = 1.0 x 10 -14 ที่ 25 C
(K w ที่ 0 C = 0.12 x 10 -14 และ ที่ 60 C = 9.6 x 10 – 14 M2)
จะได้ pK w = pH + pOH
โดยที่ pH ของ น้ำ = -log [H 30 +] = 7 และpOH ของ น้ำ = -log[ OH -] = 7
โดยทั่วไปแล้ว ค่า pH ของสารละลายที่พบอยู่ทั่วไป จะมีค่าอยู่ในช่วง 1-14 เท่านั้น อย่างไรก็ตาม ค่า pH อาจแสดงค่าเป็นลบหรือมีค่ามากกว่า 14 ได้เช่นเดียวกัน
ตัวอย่าง ค่า pH ของนมสด เท่ากับ 6.5 ถ้านมเสีย (เปรี้ยว) ค่า pH ของนมเสียจะมากหรือน้อยกว่านมสด
ตอบ น้อยกว่า
ตัวอย่าง จงหาค่า pH ของสารละลายที่เจือจางของ HCl เข้มข้น 1.0 x 10 – 8 M
วิธีทำ HCl เจือจาง แตกตัวได้ H + 1.0 x 10 – 8 M และน้ำแตกตัวได้ H+ 1.0 x 10 – 7 M
ปริมาณ H + ที่เกิดขึ้น = 1.0 x 10 -8 + 1.0 x 10 – 7 M
pH = -log (1.0 x 10 -8 + 1.0 x 10 -7 )
= 6.96
สารละลายบัฟเฟอร์ ( Buffer Solution)
สารละลายบัฟเฟอร์ คือ สารละลายที่สามารถต้านทานการเปลี่ยนแปลงค่า pH ของสารละลายได้
สารละลายบัฟเฟอร์ คือ สารละลายที่ค่า pH จะไม่เปลี่ยนแปลงเมื่อนำไปทำให้เจือจางหรือเข้มข้นขึ้น
สารละลายบัฟเฟอร์ คือ สารละลายที่ประกอบไปด้วยกรดอ่อนกับเกลือของกรดอ่อนหรือเบสอ่อนกับเกลือของเบสอ่อน และสารในระบบจะไม่ทำปฏิกิริยากัน โดยที่กรดในระบบจะคอยทำปฏิกิริยากับเบสที่เติมลงไป และเบสในระบบจะคอยทำปฏิกิริยากับกรดที่เติมลงไป
ตัวอย่าง จงหา pH ของสารละลายที่ประกอบด้วย 0.10 M NH 3 และ 0.20 M NH 4Cl เมื่อ K b ของ NH 3 เท่ากับ 1.8×10 -5 ที่ 25 oC
วิธีทำ สมดุลการแตกตัวของเบส :
ความเข้มข้น ( M) NH 3(aq) + H 2O (1) NH 4 + (aq) + OH – (aq)
NH 4 + (aq) + OH – (aq)
……………………………………………….. เริ่มต้น ……………. 0.10 …………………………………0.20 …………0
……………………………………………….. เปลี่ยนแปลง ………. -x ……………………………………+x …………..+x
……………………………………………….. ที่สมดุล ……………… 0.10-x …………………………….0.20+x …….x
ค่าคงที่การแตกตัวของเบสอ่อน :
K b = 
1.8 x 10 -5 = 
ใช้วิธีประมาณว่า 0.20 + x ~ 0.20 และ 0.10 – x ~ 0.10 จะได้
 = 1.8 x 10 -5
= 1.8 x 10 -5
……………………………………………………………….. x = [ OH – ] = 1.8×10 -5 x  = 9.0 x 10 -5
= 9.0 x 10 -5
……………………………………………………………… pH = 14.00 – pOH = 14.00 + log[ OH – ]
…………………………………………………………….. 14.00 + log (9.0 x 10 -5) = 14.00 – 5.05 = 8.95
ถ้าเติมกรดปริมาณเล็กน้อยลงไปในสารละลายบัฟเฟอร์นี้ สมการที่เกิดขึ้นคือ NH 3 + H + = NH 4 +
ถ้าเติมเบสปริมาณเล็กน้อยลงไปในสารละลายบัฟเฟอร์นี้สมการที่เกิดขึ้นคือ NH 4 ++ OH -= NH 3+H 2O
การเลือกใช้สารละลายบัฟเฟอร์ที่เหมาะสม
ตัวอย่าง ต้องการเตรียมสารละลายบัฟเฟอร์ที่มี pH คงที่ = 4.30 จะต้องเลือกใช้สารละลายบัฟเฟอร์จากขวดใดต่อไปนี้
ขวดที่ 1 HS0 4 – / SO 4 2- Ka = 1.2 x 10 -2
ขวดที่ 2 HOAc / OAc – Ka = 1.8 x 10 -5
ขวดที่ 3 HCN / CN – Ka = 4.0 x 10 -10
วิธีทำ สารละลาย pH = 4.30 [H +] = 5.0 X 10 – 5 M
เลือกใช้ HOAc / OAc – เพราะมีค่า Ka ใกล้เคียงกับ [H +] = 5.0 X 10 – 5 M ที่คำนวณได้มากที่สุด
แต่จะต้องมีการปรับอัตราส่วนของกรด ต่อเบส
………….. acid + H 2O = H 3O + + conjugate base
เมื่อ H + = 5.0 X 10 –5 และ Ka = 1.8 x 10 -5 จะได้ [HOAc] / [OAc – ] = 2.8
อัตราส่วนนี้จะคงที่เสมอ ไม่ว่าจะเติมน้ำทำให้เจือจาง หรือใช้ปริมาตรเท่าไร
อินดิเคเตอร์
อินดิเคเตอร์ คือ สารที่ใช้ทดสอบกรด-เบสของสารละลาย อินดิเคเตอร์ทั่วไปมีสมบัติเป็นกรดอ่อน เป็นสารที่เปลี่ยนสีได้เมื่อ pH ของสารละลายเปลี่ยนไป *โดยทั่วไปจะใช้ HIn แทนสูตรทั่วไปของอินดิเคเตอร์ สมการการแตกตัวของอินดิเคเตอร์
HIn (aq) + H 2O (l)  H 3O + (aq) + In – (aq)
H 3O + (aq) + In – (aq)
Ka = [H 3O +][ In – ] / [ HIn]
-
ยูนิเวอร์ซัลอินดิเคเตอร์ สามารถบอกความเป็นกรดเป็นเบสของสารละลายได้ และบอกค่า pH ได้
การเปลี่ยนสีของอินดิเคเตอร์
HIn (aq) + H 2O (l)  H 3O + (aq) + In – (aq)
H 3O + (aq) + In – (aq)
แดง …………………………………………………………………… น้ำเงิน
-
ถ้าเติมกรดลงไปเปรียบเสมือนเติม H 3O + สมดุลจะย้อนกลับจะได้สารละลายสีแดง
-
ถ้าเติมเบสเปรียบเสมือนเติม OH – , OH – จะไปดึง H 3O + ให้กลายเป็นน้ำสมดุลเลื่อนไปข้างหน้าสารละลายเป็นสีน้ำเงิน
หลักการเลือกอินดิเคเตอร์ ควรเลือกสารที่มีการเปลี่ยนสีตามการเปลี่ยนค่า pH เเละ สีสังเกตได้ชัด
การคำนวณหาช่วง pH ช่วง pH = -log K Hin + 1
ขอบคุณแหล่งข้อมูล https://uniquenessiam.wordpress.com/