สรุปเนื้อหาเรื่อง ไฟฟ้าเคมี ฟิตโค้งสุดท้ายก่อนสอบ PAT2
เลขออกซิเดชัน เลขออกซิเดชัน ย่อว่า ON.
|
1.
|
เลขออกซิเดชันของธาตุอิสระมีค่าเป็น 0 เช่น Na, O2 และ P4
|
|
2.
|
โลหะแอลคาไล (alkali metal = หมู่ IA) มีเลขออกซิเดชันเป็น +1
โลหะแอลคาไลน์เอิร์ท (หมู่ IIA) มีเลขออกซิเดชันเป็น +2 |
|
3.
|
H มีเลขออกซิเดชันเป็น +1 ยกเว้นเมื่อเป็นสารประกอบโลหะไฮไดรด์ เช่น NaH อะตอมของธาตุ H มีเลขออกซิเดชันเป็น -1
|
|
4.
|
O มีเลขออกซิเดชันเป็น -2 ยกเว้นในสารประกอบเปอร์ออกไซด์ (peroxide) และสารประกอบซูเปอร์ออกไซด์ (superoxide)
– สารประกอบเปอร์ออกไซด์ เช่น H2O2 อะตอมของธาตุ O มีเลขออกซิเดชันเป็น -1 และ – สารประกอบซูเปอร์ออกไซด์ เช่น Na2O อะตอมของธาตุ O มีเลขออกซิเดชันเป็น -1/2 |
|
5.
|
เลขออกซิเดชันของไอออนอะตอมเดี่ยวมีค่าเท่ากับประจุของไอออนนั้น เช่น
– Na+ มีเลขออกซิเดชันเป็น +1 – O2- มีเลขออกซิเดชันเป็น -2 เลขออกซิเดชันของไอออนที่เป็นหมู่อะตอมมีผลรวมของเลขออกซิเดชันเท่ากับประจุของไอออนนั้น เช่น
– SO42- อะตอมของธาตุ S มีเลขออกซิเดชันเป็น +6 และอะตอมของธาตุ O มีเลขออกซิเดชันเป็น -2 |
|
6.
|
ผลรวมของเลขออกซิเดชันของสารที่เป็นกลางทางไฟฟ้ามีค่าเป็น 0 เช่น
– NaCl อะตอมของธาตุ Na มีเลขออกซิเดชันเป็น +1 และ อะตอมของธาตุ Cl มีเลขออกซิเดชันเป็น -1 ส่วน – HNO3 อะตอมของธาตุ H มีเลขออกซิเดชันเป็น +1 อะตอมของธาตุ N มีเลขออกซิเดชันเป็น +5 และอะตอมของธาตุ O มีเลขออกซิเดชัน เป็น -2 |
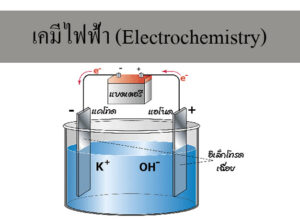
1. เซลล์กัลวานิก (Galvanic cell) คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานเคมีเป็นพลังงานไฟฟ้า เกิดจากสารเคมีทำปฏิกิริยากันในเซลล์ แล้วเกิดกระแสไฟฟ้า เช่น ถ่านไฟฉาย เซลล์แอลคาไลน์ เซลล์ปรอท เซลล์เงิน แบตเตอรี
ขั้วไฟฟ้า มี 2 ชนิด
1.1 ขั้วว่องไว (Active electrode) ได้แก่ ขั้วโลหะทั่วไป เช่น Zn Cu Pb ขั้วพวกนี้บางโอกาสจะมีส่วนร่วมในปฏิกิริยาด้วย
1.2 ขั้วเฉื่อย (Inert electrode) คือ ขั้วที่ไม่มีส่วนร่วมใดๆ ในการเกิดปฏิกิริยาเคมี เช่น Pt C(แกรไฟต์)
ในเซลล์ไฟฟ้าปกติ จะประกอบด้วยขั้วไฟฟ้า 2 ขั้วเสมอ ดังนี้
1. ขั้วแอโนด (Anode) คือ ขั้วที่เกิดออกซิเดชัน
2. ขั้วแคโทด (Cathode) คือ ขั้วที่เกิดรีดักชัน
การเขียนแผนภาพของเซลล์กัลวานิกมีหลักดังนี้
ปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์
•ปฏิกิริยารีดอกซ์ คือ ปฏิกิริยาเคมี ที่มีการแลกเปลี่ยนอิเล็กตรอนระหว่างสารตั้งต้นทำให้เลขออกซิเดชันมีการเปลี่ยนแปลงไป ซึ่งจะทำให้มีอะตอมของธาตุบางตัวสูญเสียหรือได้รับอิเล็กตรอน จะเรียกปฏิกิริยาที่เกิดการเสียอิเล็กตรอนว่า ปฏิกิริยาออกซิเดชัน (Oxidation) และเรียกปฏิกิริยาที่มีการรับอิเล็กตรอนว่า ปฏิกิริยารีดักชัน (Reduction) เช่น
MnO2 (s)+ 2KBr(aq)+ 2H2SO4 (aq) ® MnSO4 (aq)+K2SO4(aq)+2H2O(l) + Br2 (l)
16.2 การดุลสมการรีดอกซ์
ปฏิกิริยารีดอกซ์ เป็นปฏิกิริยาที่มีการเปลี่ยนแปลงเลขออกซิเดชัน โดยมีทั้งเลขออกซิเดชันลดลงและเพิ่มขึ้น หรือเป็นปฏิกิริยาที่มีการให้และรับอิเล็กตรอน (มีการถ่ายโอนอิเล็กตรอน) ดังนั้น การดุลสมการของปฏิกิริยารีดอกซ์ จึงใช้ 2 วิธี คือ การใช้เลขออกซิเดชันที่เปลี่ยนแปลงไป และใช้การให้และรับอิเล็กตรอน (หรือ การใช้ครึ่งปฏิกิริยา)
การดุลสมการทั่วไป เป็นการทำจำนวนอะตอมของธาตุต่าง ๆ ของสารตั้งต้น เท่ากับจำนวนอะตอมของธาตุต่าง ๆ ของสารผลิตภัณฑ์ หรือทำจำนวนอะตอมของธาตุต่าง ๆ ทางซ้าย และขวาของสมการให้เท่ากัน สำหรับปฏิกิริยารีดอกซ์ นอกจากจะต้องทำจำนวนอะตอมของธาตุต่าง ๆ ทางซ้ายและขวาให้เท่ากัน ยังต้องทำเลขออกซิเดชันที่เปลี่ยนแปลงไปให้เท่ากัน หรือต้องทำจำนวนอิเล็กตรอนที่ให้และรับให้เท่ากัน และถ้าเป็นการดุลสมการไอออนิก ต้องทำจำนวนประจุทางซ้ายและขวาให้เท่ากันอีกด้วย
16.2.1 การดุลสมการรีดอกซ์โดยใช้เลขออกซิเดชัน
การดุลสมการรีดอกซ์โดยใช้วิธีเลขออกซิเดชันที่เปลี่ยนแปลง (The Oxidation Number Change Method) เป็นการดุลสมการของปฏิกิริยารีดอกซ์ โดยทำเลขออกซิเดชันที่ลดลงเท่ากับเลขออกซิเดชันที่เพิ่มขึ้น แล้วทำจำนวนอะตอมของธาตุต่าง ๆ ทางซ้ายและทางขวาให้เท่ากัน แต่ถ้าเป็นสมการไอออนิกต้องทำค่าประจุรวมทางซ้าย และทางขวาให้เท่ากันด้วย
หลักทั่วไปของการดุลสมการรีดอกซ์โดยวิธีเลขออกซิเดชันที่เปลี่ยนแปลง ดังนี้
1. เขียนสมการของปฏิกิริยาที่ยังไม่ดุล แสดงเลขออกซิเดชันของธาตุที่เปลี่ยนแปลงไป และ แสดงเลขออกซิเดชันที่เพิ่มขึ้น และลดลงไว้ข้างล่าง โดยคิดต่อสารตั้งต้นที่เป็นตัวออกซิไดส์หรือตัวรีดิวซ์นั้น 1 โมเลกุล
2. ทำเลขออกซิเดชันที่เพิ่มขึ้นและลดลงให้เท่ากัน ด้วยกาคูณไขว้สลับค่าเลขออกซิเดชันที่เพิ่มขึ้นและลดลงนั้น
3. ทำจำนวนอะตอมของธาตุมี่เปลี่ยนเลขออกซิเดชัน ทั้งซ้ายและทางขวาให้เท่ากัน
4. ดุลจำนวนอะตอมของธาตุอื่น ๆ ที่ไม่เปลี่ยนแปลงเลขออกซิเดชันให้เท่ากัน ถ้ามี H2O ( H และ O ไม่เปลี่ยนแปลงเลขออกซิเดชัน) รวมอยู่ด้วยให้ดุลเป็นอันดับสุดท้าย และในการดุล H2O ให้ทำจำนวนอะตอม H ซ้ายและขวาให้เท่ากัน
5. สำหรับสมการไอออนิก เมื่อดุลถึงขั้นที่ 3 ให้ดุประจุทั้งทางซ้ายและขวาให้เท่ากันแล้วจึงดุลขั้นที่ 4 ต่อ ไป
6. สมการที่ดุลแล้ว ต้องทำเลขสัมประสิทธิ์ข้างหน้าของสารทุกชนิดเป็นตัวเลขอย่างต่ำ
2 การดุลสมการรีดอกซ์โดยใช้ครึ่งปฏิกิริยา
การดุลสมการรีดอกซ์โดยใช้วิธีการครึ่งปฏิกิริยา (Half reaction Method) หรือ วิธีการไอออน – อิเล็กตรอน (Ion-electron Method) เป็นวิธีที่ดุลสมการด้วยการทำจำนวนอิเล็กตรอนที่ให้และรับให้เท่ากัน สมการที่จะดุลด้วยวิธีนี้ต้องเป็นสมการไอออนิก ถ้าไม่เป็นสมการไอออนิกต้องเปลี่ยนเป็นสมการไอออนิกก่อน แล้วจึงดุลได้
หลักการดุลสมการโดยใช้วิธีการครึ่งปฎิกิริยา
- ใช้การเปลี่ยนเลขออกซิเดชันของธาตุ แบ่งส่วนที่ถูกออกซิไดส์ และถูกรีดิวซ์ เขียนโครงครึ่งปฏิกิริยาไอออนิกสุทธิ 2 โครง โดยโครงหนึ่งเป็นส่วนที่ถูกออกซิไดส์ และอีกส่วนหนึ่งถูกรีดิวซ์
- ดุลแต่ละครึ่งปฏิกิริยาที่แยกได้
2.1. ดุลอะตอมของธาตุที่ถูกออกซิไดซ์ และที่ถูกรีดิวซ์ ทั้งสารตั้งต้นและผลิตภัณฑ์ ยกเว้น O และ H ยังไม่ดุล
2.2 ดุลธาตุออกซิเจนด้วยการเติมน้ำ (H2O) เติม H2O ลงข้าวที่มีออกซิเจนน้อยกว่า
2.3 ในปฏิกิริยาที่เป็นกรดเติม H+ ลงในข้างที่มีไฮโดรเจนน้อยกว่าของสมการ เพื่อดุลอะตอมของ H
2.4. เติมจำนวนอิเล็กตรอนลงในข้างที่มีประจุมาก จำนวนอิเล็กตรอนที่เติมลงไปเท่ากับผลต่างระหว่างประจุรวมทั้ง 2 ข้าง
2.5 สำหรับปฏิกิริยาที่เป็นเบสเมื่อดุลถึงขึ้นนี้ถ้าในสมการมี H+ เกิดขึ้นไม่ว่าอยู่ทางข้างซ้ายหรือขวาให้ทำลาย H+ ทั้งหมดด้วยการบวก OH+ เข้าไปในสมการทั้งข้างซ้ายและขวาด้วยจำนวนเท่ากับจำนวน H+ นั้น เพื่อสะเทินกรด (H+ ) ทั้งหมดด้วย OH– จะได้สมการของครึ้งปฏิกิริยาแบบรีดักชันหรือแบบออกซิเดชันที่ดุลแล้ว
- ทำจำนวนอิเล็กตรอนในสมการของปฏิกิริยาออกซิเดชัน และรีดักชันให้เท่ากันแล้วนำสมการทั้งหมดมาบวก อิเล็กตรอนหักล้างหมดไป จะได้สมการของปฏิกิริยารีดอกซ์ที่ดุลแล้วตามต้องการ
ตรวจนับ จำนวนอะตอมของธาตุแต่ละธาตุเท่ากัน และประจุรวมข้างซ้าเท่ากับประจุรวมข้างขวาแสดงสมการสุทธิดุล
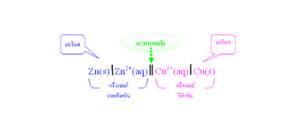
1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn2+(aq)
2. เขียนครึ่งเซลล์เซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu2+(aq)/Cu(s)
3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับแก๊ส ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับแก๊สและระหว่างไอออนในสารละลาย เช่น Pt(s)/H2(g,1 atm)/H+(aq)
4. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ทั้งสอง เช่น
Zn(s)/Zn2+(aq)// Cu2+(aq)/Cu(s)
Pt(s)/H2(g,1 atm)/H+(1 mol/dm3)// Cu2+(1 mol/dm3)/Cu(s)
5. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาคคั่นระหว่างไอออนทั้งสอง เช่น
Fe(s)/Fe2+(aq),Fe3+(aq)// Cu2+(aq)/Cu(s)
ศึกษาเกี่ยวกับ j ปฏิกิริยาเคมีที่ทำให้เกิดกระแสไฟฟ้า k กระแสไฟฟ้าทำให้เกิดปฏิกิริยาเคมี
หากใช้การถ่ายเทอิเล็กตรอนเป็นเกณฑ์แล้ว Þ ปฏิกิริยาเคมีแบ่งเป็น 2 ประเภท
j ปฏิกิริยาที่มีการถ่ายเท e– เรียกว่าปฏิกิริยารีดอกซ์ (Redox Reaction)
k ปฏิกิริยาที่ไม่มีการถ่ายเท e– เรียกว่าปฏิกิริยานอนรีดอกซ์ (Nonredox Reaction)
ปฏิกิริยารีดอกซ์ (Redox Reaction หรือ Oxidation-reduction Reaction)
Ä ปฏิกิริยารีดอกซ์หมายถึงปฏิกิริยาเกี่ยวกับการถ่ายเท e–
ตัวอย่าง เมื่อนำแผ่นโลหะทองแดง (Cu) จุ่มลงในสารละลายของ AgNO3 พบว่าที่แผ่นโลหะ Cu มีของแข็งสีขาวปนเทามาเกาะอยู่ และเมื่อนำมาเคาะจะพบว่าโลหะ Cu เกิดการสึกกร่อน ส่วนสีของสารละลาย AgNO3 ก็จะเปลี่ยนจากใสไม่มีสีเป็นสีฟ้า
การเปลี่ยนแปลงที่เกิดขึ้นนี้อธิบายได้ว่าการที่โลหะทองแดงเกิด การสึกกร่อนเป็นเพราะโลหะทองแดง(Cu) เกิดการเสียอิเล็กตรอนกลายเป็น Cu2+ ซึ่งมีสีฟ้าและเมื่อ Ag+ รับอิเล็กตรอนเข้ามาจะกลายเป็น Ag (โลหะเงิน) มาเกาะอยู่ที่แผ่นโลหะทองแดง
ปฏิกิริยาที่เกิดขึ้น เขียนในรูปสมการได้ดังนี้
Cu(s) ® Cu2+(aq) + 2 e–
Ag+(aq) + e– ® Ag(s)
Q e– ที่ถ่ายเทต้องเท่ากัน \ สมการเคมีที่เกิดขึ้นที่แท้จริงต้องเป็น
Cu(s) ® Cu2+(aq) + 2 e–
2Ag+(aq) + 2 e– ® 2Ag(s)
ปฏิกิริยาที่เกิดขึ้นในแต่ละสมการเรียกว่าครึ่งปฏิกิริยา ซึ่งการเกิดปฏิกิริยาถ่ายเท e– จะเกิดขึ้นได้สมบูรณ์ก็ต่อเมื่อต้องนำครึ่งปฏิกิริยาทั้งสองมารวมกัน เขียนเป็นสมการได้ดังนี้
Cu(s) + Ag+(aq) ® Cu2+(aq) + 2Ag(s) ¬ Redox Reaction
สรุปได้ว่าการเกิดปฏิกิริยารีดอกซ์จะต้องประกอบไปด้วย
j สารที่ให้ e– เรียกว่าตัวรีดิวซ์ Þ เกิดปฏิกิริยาออกซิเดชัน (Oxidation Reaction)
k สารที่รับ e– เรียกว่าตัวออกซิไดซ์ Þ เกิดปฏิกิริยารีดักชัน (Reduction Reaction)
เซลล์ไฟฟ้าเคมี
เนื่องจากการที่สารที่ให้ e– และสารที่รับ e– สัมผัสกันโดยตรง จะไม่สามารถแสดงกระแสไฟฟ้าที่เกิดขึ้นได้ ดังนั้นหากต้องการให้มีกระแสไฟฟ้าเกิดขึ้นต้องมีการนำลวดตัวนำไฟฟ้าต่อเชื่อมเข้าไประหว่างขั้วไฟฟ้าของครึ่งเซลล์ที่ให้ e– และครึ่งเซลล์ที่รับ e– และพร้อมกับโวลต์มิเตอร์ และสะพานเกลือเชื่อมระหว่างครึ่งเซลล์ทั้งสอง
เช่น เซลล์ไฟฟ้าเคมี
ขั้วไฟฟ้า e– ® e– ® ขั้วไฟฟ้า
Cu สะพานเกลือ Ag
Cu2+ Ag+
Cu ® Cu2+ + 2 e– Ag+ + e– ® Ag
ครึ่งเซลล์ Oxidation Reduction
ขั้วไฟฟ้า ลบ (อาโนด) บวก (คาโทด)
ปฏิกิริยาที่เกิดขึ้น Cu(s) + 2Ag+(aq) ® Cu2+(aq) + 2Ag(s)
แผนภาพเซลล์ไฟฟ้าเคมี
Ä หากปฏิกิริยารีดอกซ์ที่เกิดขึ้นเป็น A(s) + B+(aq) ® A+(aq) + B(s)
แผนภาพเซลล์ไฟฟ้าเคมี Þ A(s) | A+(aq) | | B+(aq) | B(s)
ครึ่งเซลล์ออกซิเดชัน ครึ่งเซลล์รีดักชัน
หมายเหตุ Þ ¬ | | แทนสะพานเกลือ และแต่ละครึ่งเซลล์ให้ใช้เครื่องหมาย | คั่นระหว่างสารต่างสถานะ
| คั่นระหว่างสารต่างสถานะ
k หากต้องการระบุความเข้มข้นให้เขียนไว้ในวงเล็บแล้ววางหลังสารละลาย
เช่น Cu(s) | Cu2+(aq)(0.1M) | | Ag+(aq)(0.1M) | Ag(s)
® หากสารในสถานะเดียวกันมีมากกว่า 1 ชนิด ให้ใช้เครื่องจุลภาค ( , ) คั่น
เช่น Fe(s) | Fe2+(aq) , Fe3+(aq) | | Cu2+(aq) | Cu(s)
¯ หากมีความดันเกี่ยวข้อง ให้ระบุความดันในวงเล็บ แล้ววางหลังก๊าซนั้น
เช่น Pt(s) | H2(atm) | H+(aq) | | Ag+(aq) | Ag(s)
ศักย์ไฟฟ้ามาตรฐาน (E°)
ครึ่งเซลล์มาตรฐานที่ใช้เปรียบเทียบความสามารถในการให้รับ e– ของครึ่งเซลล์ต่างๆ จะใช้ครึ่งเซลล์ไฮโดรเจนเขียนแทนด้วย Pt(s) | H2(1atm) | H+(1M) และกำหนดให้ค่าศักย์ไฟฟ้าของไฮโดรเจนที่สภาวะมาตรฐาน(25°C,1atm) มีค่าเท่ากับศูนย์โวลต์
= 0.00 Volt
การวัดค่าศักย์ไฟฟ้ามาตรฐาน ของเซลล์ไฟฟ้าใดๆ ทำได้โดยการนำครึ่งเซลล์มาตรฐานไฮโดรเจนต่อกับครึ่งเซลล์ที่สนใจ และขั้วไฟฟ้าจะต้องจุ่มอยู่ในสารละลายเข้มข้น 1 Molarโดย
E°Cell = E°คาโทด – E°อาโนด
ข้อควรทราบเกี่ยวกับค่า E°
¬ ถ้ามีการกลับสมการ Þ ค่า E° จะเท่าเดิม แต่เครื่องหมายตรงกันข้าม
k ถ้ามีการคูณสมการด้วยตัวเลขใดๆ Þ ค่า E° จะเท่าเดิม ไม่เปลี่ยนแปลง
® ค่า E°reduction ยิ่งมาก แสดงว่าสารนั้นยิ่งรับ e– ได้ดี (แนวโน้มความเป็นตัวออกซิไดซ์มากขึ้น)
ค่า E°reduction ยิ่งต่ำ แสดงว่าสารนั้นยิ่งให้ e– ได้ดี (แนวโน้มความเป็นตัวรีดิวซ์มากขึ้น)
Þ โดยทั่วไปเมื่อกล่าวถึง E° หากไม่มีการระบุว่าเป็น E°reduction หรือ E°oxidation ให้ถือว่าเป็น E°reduction
ประโยชน์ของค่า E°reduction
¬ ใช้เปรียบเทียบความสามารถในการเป็นตัวรีดิวซ์และตัวออกซิไดซ์
Ä สารที่ให้ e– ได้ดี E° ต่ำ , สารที่รับ e– ได้ดี E° สูง
เช่น Þ Zn2+(aq) + 2 e– ® Zn(s) E° = – 0.76 Volt
Ag+(aq) + e– ® Ag(s) E° = 0.80 Volt
พิจารณา Þ <
\ ตัวรีดิวซ์ : Zn > Ag
ตัวออกซิไดซ์ : Ag+ > Zn2+
k ใช้คำนวณค่าศักย์ไฟฟ้าของเซลล์และครึ่งเซลล์
อาศัยหลัก Þ E°Cell = E°คาโนด – E°อาโนด Ü DE°
= E°ขั้วบวก – E°ขั้วลบ
= E°สูง – E°ต่ำ
ประโยชน์ของค่า E°Cell
E°Cell > 0 Þ ปฏิกิริยาเกิดได้
E°Cell < 0 Þ ปฏิกิริยาเกิดไม่ได้ (เกิดในทิศตรงข้าม)
E°Cell = 0 Þ ปฏิกิริยาเกิดไม่ได้แน่นอน
ตัวอย่างการคำนวณศักย์ไฟฟ้าของครึ่งเซลล์
- เมื่อนำครึ่งเซลล์ของ Ag | Ag+ ต่อกับครึ่งเซลล์ของ Pt | H2 | H+ พบว่าเข็มของโวลต์มิเตอร์เบนหาขั้ว Ag
และอ่านค่าได้ 0.80 Volt ให้หาค่า E° ของ Ag+ + e– ® Ag
ทำ จากการที่เข็มโวลต์เบนเข้าหาขั้ว Ag
แสดงว่า Ag | Ag+ รับ e–
Pt | H2 | H+ ให้ e–
จาก E°Cell = E°คาโทด – E°อาโนด
0.80 = –
0.80 = – 0
\ = 0.80 Volt
นั่นหมายความว่า Þ Ag+ + e– ® Ag E° = 0.80 Volt #
ตัวอย่างการคำนวณศักย์ไฟฟ้าของเซลล์
- เมื่อนำครึ่งเซลล์ของ Fe | Fe2+ ต่อเข้ากับ Ni | Ni2+ ให้หาค่า E°Cell
กำหนด Fe2+ + 2 e– ® Fe E° = – 0.41 Volt
Ni2+ + 2 e– ® Ni E° = – 0.23 Volt
ทำ E°Cell = E°สูง – E° ต่ำ = – 0.23 – ( – 0.41)
= 0.18 Volt #
- ให้พิจารณาว่าปฏิกิริยา 2Al(s) + 3Sn4+(aq) ® 2Al3+ + 3Sn2+ เกิดขึ้นได้หรือไม่
กำหนด Sn4+ + 2 e– ® Sn2+ E° = – 0.14 Volt
Al3+ + 3 e– ® Al E° = – 1.66 Volt
ทำ วิธี 1 วิเคราะห์จากค่า E°
Ä > \ Al ให้ e– และ Sn4+ รับ e–
\ ปฏิกิริยาที่โจทย์ให้จึงเกิดขึ้นได้ #
วิธี 2 จาก E°Cell = E°สูง – E°ต่ำ
= – 0.14 – ( – 1.66) Volt
= 0.82 Volt
จากค่า E°Cell เป็นบวก แสดงว่าปฏิกิริยาจะเกิดขึ้นได้ก็ต่อเมื่อ Sn4+ ต้องรับ e– และ Al ต้องให้ e–
ซึ่งสอดคล้องกับสมการที่โจทย์ให้ \ ปฏิกิริยาที่โจทย์ให้จึงเกิดขึ้นได้ #
สมการของเนินส์
การคำนวณค่าศักย์ไฟฟ้าของครึ่งเซลล์หรือศักย์ไฟฟ้าของเซลล์ที่ไม่ใช่สภาวะมาตรฐาน ให้คำนวณหาค่าศักย์ไฟฟ้า (E) ผ่านสมการของเนินส์
- ศักย์ไฟฟ้าของครึ่งเซลล์
aA + n e– bB
E = E°- log( )
- ศักย์ไฟฟ้าของเซลล์
aA + bB cC + dD
ECell = E°Cell – log อย่าลืม = Keq
- ให้หาค่าศักย์ไฟฟ้าของครึ่งเซลล์ Zn | Zn2+(0.01M)
กำหนด Zn2+(aq) + 2 e– ® Zn(s) E° = – 0.763 Volt
ทำ จาก E = E°- og ()
= – 0.763 – log () = – 0.822 Volt #
- ให้หาค่าศักย์ไฟฟ้าของเซลล์จากปฏิกิริยา Co(s) + Ni2+(aq) Co2+(aq) + Ni(s)
E°Cell = 0.03 Volt
เมื่อ [Co2+] = 0.1M และ [Ni2+] = 1M
ทำ Ecell = E°Cell – log ()
= 0.03 – og () = 0.03 + 0.03 Volt
\ ECell = 0.06 Volt #
- ให้หาค่า Keq ของปฏิกิริยา Pb2+(aq) + Ni(s) Pb(s) + Ni2+(aq) ECell = 0.15 Volt
กำหนด Pb2+ + 2 e– ® Pb E° = – 0.763 Volt
Ni2+ + 2 e– ® Ni E° = – 0.25 Volt
ทำ จาก ECell = E°Cell – logKeq ¬
หา E°Cell
Q ECell = E°สูง – E°ต่ำ = – 0.13 – ( – 0.25) Þ 0.12 Volt
แทนค่าใน ¬ 0.15 = 0.12 – logKeq
0.15 – 0.12 = – 0.0245 logKeq
logKeq = – = – 1
\ Keq = 0.1 #
อิเล็กโตรลิซิส (Electrolysis)
Ä ปฏิกิริยาใดที่เกิดขึ้นไม่ได้ เช่น Cu(s) + Zn2+(aq) ® Cu2+(aq) + Zn(s) หากต้องการทำให้เกิดปฏิกิริยาก็สามารถทำได้โดยผ่านพลังงานไฟฟ้าจากภายนอก ซึ่งปฏิกิริยาที่ได้จากการแยกสลายด้วยด้วยไฟฟ้านี้มีชื่อเรียกว่าอิเล็กโตรลิซิส (Electrolysis)
ส่วนประกอบที่สำคัญของ Elctrolytic Cell
- แหล่งพลังงานไฟฟ้าจากภายนอก
- ขั้วไฟฟ้า
- สารละลายอิเล็กโตรไลท์
ลักษณะการเกิดปฏิกิริยาเป็นดังนี้
สารที่ให้ e– แก่ขั้วบวก เกิดปฏิกิริยา Oxidation ® ขั้วอาโนด
สารที่รับ e– จากขั้วลบ เกิดปฏิกิริยา Reduction ® ขั้วคาโทด
การดุลสมการรีดอกซ์
ต้องผ่านขั้นตอนการหาเลขออกซิเดชัน
Ä โดยเลขออกซิเดชันจะหมายถึงตัวเลขแสดงค่าประจุไฟฟ้าที่แท้จริงหรือประจุไฟฟ้าสมมติของธาตุ
เกณฑ์การกำหนดค่าเลขออกซิเดชัน (O.N.)
- ธาตุอิสระ (ไม่รวมตัวกับธาตุอื่น มีค่า O.N. = ศูนย์)
เช่น Mg , O2 , O3 , S8 , Cl2 , P4
- ธาตุหมู่ 1 ในสารประกอบ มีค่า O.N. = 1
เช่น LiNo3 , NaCl , KClO3
- ธาตุหมู่ 2 ในสารประกอบ มีค่า O.N. = 2
เช่น MgCl2 , CaCO3 , BeCl2
- ธาตุไฮโดรเจน ในสารประกอบ มีค่า O.N. = 1
เช่น HCl , NH3 , H2O
ยกเว้น ในสารประกอบของโลหะ เช่น NaH , AlH3 Þ H มี O.N. = -1
- ธาตุออกซิเจน ในสารประกอบ มีค่า O.N. = – 2
เช่น H2O , CO2 , Cl2O
ยกเว้น H2O2 , Na2O , NaO2 , OF Þ O มี O.N. ¹ -2
- ผลรวมของ O.N. ในสารประกอบมีค่าเป็นศูนย์
เช่น KMnO4 , MnO2 , Na2C2O4
- ผลรวมของ O.N. ในไอออนเท่ากับจำนวนประจุ
เช่น MnO4– , Cr2O72- , Fe(CN)63-
Note Þ ไอออนที่ควรจำ SO42- , CN– , NO3– , CO32- Þ ไอออนที่มี O.N. เท่ากับจำนวนประจุ
ตัวอย่างการหาเลขออกซิเดชันของธาตุ
Mn2O7 Þ 2Mn + 7O = 0 Na3PO4 Þ 3Na + P + 4O = 0
2Mn + 7(-2) = 0 3(1) + P + 4(-2) = 0
2Mn = 14 3 + P – 8 = 0
Mn = +7 # P = +5 #
MnSO4 Þ Mn + SO4 = 0 C2O42- Þ 2C + 4O = -2
Mn + (-2) = 0 2C + 4(-2) = -2
Mn = +2 # 2C = 6
C = +3 #
ขั้นตอนการดุลสมการรีดอกซ์
- หาธาตุที่มี O.N. เปลี่ยนไป ต่อ 1 อะตอมของธาตุ
- นำเลข O.N. ที่เปลี่ยนไปมาคูณไขว้ (เพื่อให้จำนวน e– ที่ถ่ายเทเท่ากัน)
- ดุลอะตอมของธาตุ (H กับ O ทำทีหลัง)
- ถ้าทอนได้ให้ทอนเป็นอัตราส่วนอย่างต่ำด้วย
ตัวอย่างการดุลสมการรีดอกซ์
- FeCl3 + SnCl2 ® FeCl2 + SnCl4
- หาเลข O.N. ที่เปลี่ยนไป ต่อ 1 อะตอมของธาตุ
FeCl3 + SnCl2 ® FeCl2 + SnCl4
+3 +2 +2 +4
รับ 1 e–
เสีย 2 e–
- คูณไขว้จำนวน e– ให้ถ่ายเทเท่ากัน
2FeCl3 + SnCl2 ® FeCl2 + SnCl4
- ดุลสมการ
2FeCl3 + SnCl2 ® 2FeCl2 + SnCl4 #
- KMnO4 + KNO2 + H2SO4 ® MnSO4 + H2O + KNO3 + K2SO4
- หาเลข O.N. ที่เปลี่ยนไป ต่อ 1 อะตอมของธาตุ
KMnO4 + KNO2 + H2SO4 ® MnSO4 + H2O + KNO3 + K2SO4
+7 +3 +2 +5
รับ 5 e–
เสีย 2 e–
- คูณไขว้จำนวน e– ให้ถ่ายเทเท่ากัน
2KMnO4 + 5KNO2 + H2SO4 ® MnSO4 + H2O + KNO3 + K2SO4
- ดุลสมการ
2KMnO4 + 5KNO2 + 3H2SO4 ® 2MnSO4 + 3H2O + 5KNO3 + K2SO4 #
การดุลสมการรีดอกซ์แบบครึ่งปฏิกิริยา
ทำตามขั้นตอนดังนี้
¬ ในสารละลายกรด
- Fe2+ + Cr2O72- ® Fe3+ + Cr3+
ทำ 1. แยกครึ่งปฏิกิริยา
Fe2+ ® Fe3+ Cr2O72- ® Cr3+
- ดุลอะตอม
Fe2+ ® Fe3+ Cr2O72- ® 2Cr3+
เติม H2O ด้านขาดออกซิเจนเท่ากับจำนวนที่ขาดออกซิเจน
Cr2O72- ® 2Cr3+ + 7H2O
เติม H+ ด้านขาดไฮโดรเจนเท่ากับจำนวนที่ขาดไฮโดรเจน
Cr2O72- + 14H+ ® 2Cr3+ + 7H2O
- ดุลประจุ (โดยการเติม e– )
จาก Fe2+ ® Fe3+ + e– จำนวนประจุเท่ากันคือ 2
Cr2O72- + 14H+ + 6 e– ® 2Cr3+ + 7H2O จำนวนประจุเท่ากันคือ 6
- ทำการถ่ายเท e– ให้เท่ากัน (โดยการคูณไขว้จำนวน e– )
6Fe2+ ® 6Fe3+ + 6 e–
Cr2O72- + 14H+ + 6 e– ® 2Cr3+ + 7H2O
- รวมสมการ
6Fe2+ + Cr2O72- + 14H+ ® 6Fe3+ + 2Cr3+ + 7H2O #
k ในสารละลายเบส
- I– + MnO4– ® I2 + MnO2
ทำ แยกครึ่งปฏิกิริยา
I– ® I2 ดุลอะตอม MnO4– ® MnO2
2I– ® I2 ดุลประจุ Q อะตอมของ Mn ดุลแล้ว
2I– ® I2 + 2 e– \ ดุล O โดยเติม H2O ด้านขาด Oเท่ากับจำนวนที่ขาด O
MnO4– ® MnO2 + 2H2O
เติม H+ ด้านขาด H เท่ากับจำนวนที่ขาด H
MnO4– + 4H+ ® MnO2 + 2H2O
Q สารละลายเบสห้ามมีกรด ดังนั้นต้องเติม OH– ทั้ง 2 ด้าน
MnO4– + 4H+ + 4OH– ® MnO2 + 2H2O + 4OH‑
Q H+ + OH– ® H2O ดังนั้นจะได้สมการเป็น
MnO4– + 4H2O ® MnO2 + 2H2O + 4OH‑ หักล้าง H2O
MnO4– + 2H2O ® MnO2 + 4OH‑ ดุลประจุ
MnO4– + 2H2O +3 e– ® MnO2 + 4OH‑
ทำ e– ที่ถ่ายเทให้เท่ากัน (โดยคูณไขว้จำนวน e– )
Oxidation Þ 2I– ® I2 + 2 e–
Reduction Þ MnO4– + 2H2O + 3 e– ® MnO2 + 4OH‑
จะได้ 6I– ® 3I2 + 6 e–
2MnO4– + 4H2O + 6 e– ® 2MnO2 + 8OH‑
รวมสมการ 6I– + 2MnO4– + 4H2O ® 3I2 + 2MnO2 + 8OH‑ #
ขอบคุณข้อมูล https://kienakrab.tripod.com/cgi-bin/10_files/100_ch13.htm






