สารเคมีในชีวิตประจำวัน.
• ในชีวิตประจำวัน เราจะต้องเกี่ยวข้องกับสารหลายชนิด ซึ่งมีสารเคมีเป็นองค์ประกอบ
• เราสามารถจำแนกเป็นสารสังเคราะห์และสารธรรมชาติ เช่น สารปรุงรสอาหาร สารแต่งสีอาหาร สารทำความสะอาด สารกำจัดแมลงและสารกำจัดศัตรูพืช เป็นต้น
• ในการจำแนกสารเคมีนั้น ใช้เกณฑ์ต่าง ๆ ดังต่อไปนี้
เกณฑ์การจำแนกสารเคมี
1. สารปรุงแต่งอาหาร
2. เครื่องดื่ม
3. สารทำความสะอาด
4. สารกำจัดแมลง และสารกำจัดศัตรูพืช
5. เครื่องสำอาง
1. สารปรุงแต่งอาหาร
1.1 ความหมายสารปรุงแต่งอาหาร สารปรุงแต่ง อาหาร หมายถึง สารปรุงรสอาหารใช้ใส่ในอาหารเพื่อทำให้อาหารมีรสดีขึ้น หรือ เพิ่มรสชาติต่างๆ เช่น
– น้ำตาล ให้รสหวาน
– เกลือ น้ำปลา ให้รสเค็ม
– น้ำส้มสายชู น้ำมะนาว ซอสมะเขือเทศ ให้รสเปรี้ยว
1.2 ประเภทของสารปรุงแต่งอาหาร แบ่งเป็น 2 ประเภท คือ
1. ได้จากการสังเคราะห์ เช่น น้ำส้มสายชู น้ำปลา ซีอิ๊ว ซอสมะเขือเทศ
2. ได้จากธรรมชาติ เช่น เกลือ น้ำมะนาว น้ำมะขามเปียก อัญชัน เป็นต้น
2. เครื่องดื่ม
เครื่องดื่ม หมายถึง สิ่งที่มนุษย์จัดเตรียมสำหรับดื่ม และมักจะมี “น้ำ”เป็นองค์ประกอบหลักบางประเภทได้คุณค่าทางโภชนาการ บางประเภทดื่มแล้วไปกระตุ้นระบบประสาท และบางประเภทดื่มเพื่อดับกระหาย
แบ่งออกเป็น 7 ประเภท ได้แก่ น้ำดื่มสะอาด น้ำผลไม้ นม น้ำอัดลม เครื่องดื่มบำรุงกำลัง ชาและกาแฟ และเครื่องดื่มแอลกอฮอล์
ประเภทของเครื่องดื่ม
1) น้ำดื่มสะอาด เป็นเครื่องดื่มที่ไม่สิ่งอื่นเจือปน เป็นประโยชน์ต่อกระบวนการต่างๆ ในร่างกาย
2) น้ำผลไม้ เป็นเครื่องดื่มที่มีประโยชน์มากอย่างหนึ่ง ควรเป็นน้ำผลไม้สด โดยผู้ผลิตจะนำผลไม้ที่มีมากในฤดูกาลมาคั้นเอาเฉพาะน้ำ
3) นม เป็นแหล่งสำคัญของแคลเซียมและโปรตีน ช่วยให้กระดูกเจริญเติบโตและแข็งแรง
4) น้ำอัดลม เป็นเครื่องดื่มที่ไม่มีส่วนผสมของแอลกอฮอล์ ประกอบด้วย น้ำ, น้ำตาล, สารปรุงแต่งที่เรียกว่า หัวน้ำเชื้อ ซึ่งเป็นส่วนผสมของสารที่ให้กลิ่นและสี, และกรดคาร์บอนิกซึ่งถูกอัดเข้าในภาชนะบรรจุ บางชนิดอาจมีส่วนผสมของน้ำผลไม้เล็กน้อย
5) เครื่องดื่มชูกำลังคือเครื่องดื่มที่ให้พลังงาน มีส่วนผสมของคาเฟอีน (Caffeine) เทารีน (Taurine)อินโนซิทอล (Inositol) และซูโครสหรือน้ำตาลทราย (Sucrose) เป็นต้นเหมาะกับกลุ่มคนที่มีความต้องการทำงานอย่างต่อเนื่องเป็นระยะเวลานาน
6) ชาและกาแฟเป็นเครื่องดื่มที่มีคาเฟอีน มีผู้บริโภคเป็นจำนวนมาก และมีการทำไร่ผลิตชาและเมล็ดกาแฟหลายแห่งด้วยกัน เป็นอุตสาหกรรมชั้นนำประเภทหนึ่ง
7) เครื่องดื่มแอลกอฮอล์ มีเอทิลแอลกอฮอล์ผสมอยู่ ได้แก่ สุรา แอลกอฮอล์มีฤทธิ์กดระบบประสาทส่วนกลาง ผู้ที่กินเหล้าในปริมาณไม่มาก จะรู้สึกผ่อนคลาย เนื่องจากแอลกอฮอล์ไปกดจิตใต้สำนึกที่
คอยควบคุมตนเองอยู่ แต่หากดื่มปริมาณมากขึ้นจะทำให้อาการเสียการทรงตัว พูดไม่ชัดหรือ หมดสติในที่สุด
3. สารทำความสะอาด
3.1 ความหมายของสารทำความสะอาด สารทำความสะอาด หมายถึง สารที่มีคุณสมบัติในการกำจัดความสกปรกต่างๆ ตลอดจนฆ่าเชื้อโรค
3.2 ประเภทของสารทำความสะอาด แบ่งตามการเกิด ได้ 2 ประเภท คือ
1) ได้จากการสังเคราะห์ เช่น น้ำยาล้างจาน สบู่ก้อน สบู่เหลว แชมพูสระผมผงซักฟอก สารทำความสะอาดพื้นเป็นต้น
2) ได้จากธรรมชาติ เช่น น้ำมะกรูด มะขามเปียก เกลือ เป็นต้นแบ่งตามวัตถุประสงค์ในการใช้งานเป็นเกณฑ์ แบ่งออกได้เป็น 4 ประเภท คือ
2.1 สารประเภททำความสะอาดร่างกาย ได้แก่ สบู่ แชมพูสระผม เป็นต้น
2.2 สารประเภททำความสะอาดเสื้อผ้า ได้แก่ สารซักฟอกชนิดต่างๆ
2.3 สารประเภททำความสะอาดภาชนะ ได้แก่ น้ำยาล้างจาน เป็นต้น
2.4 สารประเภททำความสะอาดห้องน้ำ ได้แก่ สารทำความสะอาด ห้องน้ำทั้งชนิดผงและชนิดเหลวสมบัติของสารทำความสะอาด สารทำความสะอาด เช่น สบู่ แชมพูสระผม สารล้างจาน สารทำความสะอาดห้องน้ำ สารซักฟอก บางชนิดมีสมบัติเป็นกรด บางชนิดมีสมบัติเป็นเบสซึ่ง
ทดสอบได้ด้วยกระดาษลิตมัส
สารทำความสะอาด ห้องน้ำและเครื่องสุขภัณฑ์บางชนิดมีสมบัติเป็นกรดสามารถกัดกร่อนหินปูนที่ยาไว้ระหว่างกระเบื้องปูพื้นหรือฝาห้องน้ำบริเวณ เครื่องสุขภัณฑ์ ทำให้คราบสกปรกที่เกาะอยู่หลุดลอกออกมาด้วย ถ้าใช้สาร ชนิดนี้ไปนานๆ พื้นและฝาห้องน้ำจะสึกกร่อนไปด้วย และยังทำให้ผู้ใช้เกิดความระคายเคืองของระบบทางเดินหายใจและผิวหนังอีกด้วย
4. สารกำจัดแมลง และสารกำจัดศัตรูพืช
4.1 ความหมายของสารกำจัดแมลงและสารกำจัดศัตรูพืชสารกำจัดแมลงและสารกำจัดศัตรูพืช หมายถึง สารเคมีที่ผลิตขึ้นเพื่อใช้
ป้องกันการกำจัด และควบคุมแมลงต่างๆ ไม่ให้มารบกวน มีทั้งชนิดผง ชนิดเม็ด และชนิดน้ำ
4.2 ประเภทของสารกำจัดแมลงและสารกำจัดศัตรูพืช แบ่งเป็น 2 ประเภท คือ
1. ได้จากการสังเคราะห์ เช่น สารฆ่ายุง สารกำจัดแมลง เป็นต้น
2. ได้จากธรรมชาติ เช่น เปลือกมะนาว เปลือกมะกรูด เปลือกส้ม เป็นต้น
5. เครื่องสำอาง
5.1 ความหมายของเครื่องสำอาง เครื่องสำอาง หมายถึง ผลิตภัณฑ์ที่ใช้ทา ถู นวด โรย พ่น หยอด ใส่ อบร่างกาย เพื่อใช้ทำความสะอาดเพื่อให้เกิดความสดชื่น ความสวยงาม และเพิ่มความมั่นใจ
5.2 ประเภทของเครื่องสำอาง แบ่งเป็น 5 ประเภท คือ
1 ) สำหรับผม เช่น แชมพู ครีมนวด เจลแต่งผม ฯลฯ
2 ) สำหรับร่างกาย เช่น สบู่ ครีม และโลชั่นทาผิว ยาทาเล็บ น้ำยาดับ กลิ่นตัว แป้งโรยตัว ฯลฯ
3 ) สำหรับใบหน้า เช่น ครีม โฟมล้างหน้า แป้งผัดหน้า ลิปสติก ดินสอเขียนคิ้วและดินสอเขียนขอบตา
4 ) น้ำหอม
5 ) เบ็ดเตล็ด เช่น ครีมโกนหนวด ผ้าอนามัย ยาสีฟัน ฯล
1.1 ความหมายสารเเละสมบัติของสาร
สมบัติของสาร หมายถึง ลักษณะประจำตัวของสารแต่ละชนิดซึ่งแตกต่างจากสารอื่น เช่น กระดาษติดไฟได้ แต่แม่เหล็กไม่ติดไฟ ออกซิเจนอยู่ใสสถานะก๊าซที่อุณหภูมิและความดันปกติ แต่น้ำเป็นของเหลว น้ำส้มสายชูมีรสเปรี้ยวแต่น้ำมีรสจืด น้ำมีจุดเดือด 100 เซลเซียส แต่เอธานอลมีจุดเดือด 78.5 องศาเซลเซียส สมบัติของสารแบ่งออกเป็น 2 ประเภท
1. สมบัติทางกายภาพ หมายถึง ลักษณะภายนอกของสารที่ได้จากการสังเกตหรือทราบได้จากการทดลองง่าย ๆ เช่น สี กลิ่น รส จุดเดือด จุดหลอมเหลว ความแข็ง การนำไฟฟ้า การนำความร้อน ความหนาแน่น ความถ่วงจำเพาะ ลักษณะผลึก เป็นต้น
2. สมบัติทางเคมี เป็นสมบัติที่ทราบได้โดยอาศัยการเปลี่ยนแปลงทางเคมี หรือเป็นสมบัติที่เกี่ยวกับการเปลี่ยนแปลงจากสารหนึ่งไปเป็นสารอื่น ๆ เช่น เหล็กเป็นสนิม ถ่านเมื่อเผาไหม้เกิดก๊าซคาร์บอนไดออกไซด์ สังกะสีเมื่อทำปฏิกิริยากับกรดไฮโดรคลอริกได้ก๊าซไฮโดรเจน เป็นต้น
ตัวอย่างเช่นถ้ากำหนดสมบัติของสารให้ สามารถจัดจำพวกได้หลายวิธี ซึ่งขึ้นอยู่กับเกณฑ์ที่กำหนด
โซเดียมคลอไรด์ (เกลือแกง)
มีสถานะเป็นของแข็ง
สมบัติของสาร
1. ความสามารถในการนำไฟฟ้า
– ไม่นำไฟฟ้า
2. สี
– ขาว
3. การละลายน้ำ
– ละลายได้
4. ความเป็นกรด-เบสของสารละลาย
– กลาง
แนพทาลีน (ลูกเหม็น)
มีสถานะเป็นของแข็ง
สมบัติของสาร
1. ความสามารถในการนำไฟฟ้า
–ไม่นำไฟฟ้า
2. สี
–ขาว
3. การละลายน้ำ
–ไม่ละลายน้ำ
4. ความเป็นกรด-เบสของสารละลาย
ทองแดง
มีสถานะเป็นของแข็ง
สมบัติของสาร
1. ความสามารถในการนำไฟฟ้า
–นำไฟฟ้า
2. สี
–แดงส้ม
3. การละลายน้ำ
–ไม่ละลาย
4. ความเป็นกรด-เบสของสารละลาย
เหล็ก
มีสถานะเป็นของแข็ง
สมบัติของสาร
1. ความสามารถในการนำไฟฟ้า
– นำไฟฟ้า
2. สี
เทา
3. การละลายน้ำ
–ไม่ละลาย
4. ความเป็นกรด-เบสของสารละลาย
ปรอท
มีสถานะเป็นของเหลว
สมบัติของสาร
1. ความสามารถในการนำไฟฟ้า
–นำไฟฟ้า
2. สี
–เงิน
3. การละลายน้ำ
–ไม่ละลาย
4. ความเป็นกรด-เบสของสารละลาย
จากสมบัติของสารสามารถจัดจำพวกสารได้หลายวิธีดังนี้
1. จัดสารในตารางเป็นหมวดหมู่โดยใช้สถานะเป็นเกณฑ์ สามารถแบ่งสารออกได้ 3 กลุ่ม ได้แก่
1. ของแข็ง ได้แก่ โซเดียมคลอไรด์ แคลเซียมคาร์บอเนต แนพทาลีน ทองแดง กำมะถัน โซเดียมไฮดรอกไซด์ พลาสติก และเหล็ก
2. ของเหลว ได้แก่ เอธานอล น้ำเกลือ น้ำเชื่อม ปรอท และโบรมีน
3. ก๊าซ ได้แก่ คลอรีน คาร์บอนไดออกไซด์ และไฮโดรเจน
2. จัดสารที่กล่าวมาข้างต้นเป็นหมวดหมู่โดยใช้การนำไฟฟ้าเป็นเกณฑ์ สามารถแบ่งได้ 2 กลุ่ม คือ
1. สารที่ไม่นำไฟฟ้า ได้แก่ โซเดียมคลอไรด์ แคลเซียมคาร์บอเนต แนพทาลีน กำมะถัน เอธานอล คลอรีน โซเดียมไฮดรอกไซด์ คาร์บอนไดออกไซด์ พลาสติก ไฮโดรเจน น้ำเชื่อม และโบรมีน
2. สารที่นำไฟฟ้า ได้แก่ ทองแดง น้ำเกลือ เหล็ก ปรอท
3. จัดสารที่กล่าวมาข้างต้นเป็นหมวดหมู่โดยใช้สถานะและการนำไฟฟ้าเป็นเกณฑ์ สามารถแบ่งสารออกได้ 5 กลุ่ม คือ
1. ของแข็งที่ไม่นำไฟฟ้า ได้แก่ โซเดียมคลอไรด์ แคลเซียมคาร์บอเนต แนพทาลีน กำมะถัน โซเดียมไฮดรอกไซด์ และพลาสติก
2. ของแข็งที่นำไฟฟ้าได้ ได้แก่ ทองแดง และเหล็ก
3. ของเหลวที่นำไฟฟ้าได้ ได้แก่ น้ำเกลือ และปรอท
4. ของเหลวที่ไม่นำไฟฟ้า ได้แก่ เอธานอล น้ำเชื่อม และโบรมีน
5. ก๊าซที่ไม่นำไฟฟ้า ได้แก่ คลอรีน คาร์บอนไดออกไซด์ และไฮโดรเจน
4. จัดสารที่กล่าวมาข้างต้นเป็นหมวดหมู่โดยอาศัยการละลายน้ำและความเป็นกรด-เบสของสารละลายเป็นเกณฑ์ สามารถแบ่งสารออกได้ 4 กลุ่ม คือ
1. สารที่ละลายน้ำได้และมีสมบัติเป็นกลาง ได้แก่ โซเดียมคลอไรด์ เอธานอล น้ำเกลือ และน้ำเชื่อม
2. สารที่ละลายน้ำได้และมีสมบัติเป็นกรด ได้แก่ คลอรีน คาร์บอนไดออกไซด์ และโบรมีน
3. สารที่ละลายน้ำได้และมีสมบัติเป็นเบส ได้แก่ โซเดียมไฮดรอกไซด์
4. สารที่ไม่ละลายน้ำ ได้แก่ แคลเซียมคาร์บอเนต แนพทาลีน ทองแดง กำมะถัน พลาสติก ไฮโดรเจน เหล็ก และปรอท
การจำแนกประเภทของสาร
การจำแนกสารออกเป็นหมวดหมู่ สามารถแบ่งได้หลายวิธี ขึ้นอยู่กับเกณฑ์ในการแบ่ง เช่น
>สถานะของสารเป็นเกณฑ์ แบ่งออกเป็น 3 ประเภท คือ
1. แก๊ส เช่น แก๊สคาร์บอนไดออกไซด์ แก๊สออกซิเจน เป็นต้น
2. ของเหลว เช่น น้ำ น้ำเชื่อม เป็นต้น
3. ของแข็ง เช่น โลหะ พลาสติก เป็นต้น
>การนำไฟฟ้าเป็นเกณฑ์ แบ่งออกเป็น 2 ประเภท คือ
1. สารที่นำไฟฟ้าได้
2. สารที่ไม่นำไฟฟ้า
>ลักษณะเนื้อสารเป็นเกณฑ์ แบ่งออกเป็น 2 ประเภท คือ
1. สารเนื้อเดียว
2. สารเนื้อผสม
สารเนื้อเดียว
สารเนื้อเดียว คือ สารที่มองเห็นเป็นเนื้อเดียว และถ้าตรวจสอบสมบัติของสารจะเหมือนกันทุกส่วน อาจมีองค์ประกอบเดียว หรือหลายองค์ประกอบ แบ่งเป็นสารบริสุทธิ์และสารละลาย
1. สารบริสุทธิ์ เป็นสารที่มีองค์ประกอบเพียงชนิดเดียว ได้แก่ ธาตุและสารประกอบ ซึ่งก็คือ สารที่เกิดจากองค์ประกอบมากกว่าหนึ่งชนิด แต่มีอัตราส่วนโดยมวลของสารที่เป็นองค์ประกอบ
– ธาตุ = ตะกั่ว ทองคำ เงิน แก๊สออกซิเจน เหล็ก แก๊สไนโตรเจน เป็นต้น ซึ่งธาตุแบ่งเป็นโลหะ (เช่น เหล็ก ทองคำ เงิน) อโลหะ (เช่น แก๊สออกซิเจน แก๊สไนโตรเจน) กึ่งโลหะ (เช่น อะลูมิเนียม)
– สารประกอบ = น้ำตาลทราย เกลือแกง น้ำ กรดเกลือ เป็นต้น
ตัวอย่างสารประกอบ
2. สารละลาย เป็นของผสมเนื้อเดียว มีอัตราส่วนโดยมวลของสารที่เป็นองค์ประกอบไม่คงที่ องค์ประกอบของสารละลาย มี 2 ส่วน คือ
1. ตัวทำละลาย คือ สารที่มีปริมาณมากที่สุดในสารละลาย (กรณีสถานะองค์ประกอบเหมือนกัน) หรือเป็นสารที่มีสถานะเดียวกับสารละลาย (กรณีสถานะองค์ประกอบต่างกัน)
2. ตัวละลาย คือ สารที่มีปริมาณอยู่น้อยในสารละลาย หรือมีสถานะต่างจากสารละลาย เช่น
– น้ำเกลือ เป็นสารละลาย ประกอบด้วยน้ำและเกลือ พิจารณา น้ำเกลือ มีสถานะเป็นของเหลว และน้ำก็มีสถานะเป็นของเหลว ดังนั้น น้ำจึงเป็นตัวทำละลาย ส่วนเกลือ เป็นของแข็ง จึงเป็นตัวละลาย
–อากาศ เป็นสารละลาย ประกอบด้วย
1) แก๊สไนโตรเจน ประมาณ 78%
2) แก๊สออกซิเจน ประมาณ 21%
3) แก๊สคาร์บอนไดออกไซด์และแก๊สเฉื่อย 1%
พิจารณา อากาศมีองค์ประกอบสถานะเดียวกัน คือ แก๊ส จึงต้องดูปริมาณสารที่เป็นองค์ประกอบ ดังนั้น แก๊สไนโตรเจน เป็นตัวทำละลาย (มีปริมาณมากกว่า) ส่วนแก๊สออกซิเจน แก๊สคาร์บอนไดออกไซด์และแก๊สเฉื่อยเป็นตัวละลาย
ข้อควรทราบ
ตัวทำละลาย จะมีเพียงองค์ประกอบเดียว แต่ตัวละลายสามารถมีหลายองค์ประกอบ
สารละลาย คือ ตัวทำละลาย + ตัวละลาย
ตารางแสดงตัวอย่างสารละลายชนิดต่างๆ
|
สารละลาย |
สถานะ |
ตัวทำละลาย |
ตัวละลาย |
|
1. ทองเหลือง |
ของแข็ง |
สังกะสี |
สังกะสี |
|
2. เหรียญบาท |
ของแข็ง |
ทองแดง |
ทองแดง |
|
3. เหล็กกล้า |
ของแข็ง |
เหล็ก |
เหล็ก |
|
4. นาก |
ของแข็ง |
ทองแดง |
ทองแดง |
|
5. ฟิวส์ |
ของแข็ง |
บิสมัท |
บิสมัท |
|
6. น้ำเกลือ |
ของเหลว |
น้ำ |
น้ำ |
|
7. น้ำเชื่อม |
ของเหลว |
น้ำ |
น้ำ |
|
8. น้ำโซดา |
ของเหลว |
น้ำ |
น้ำ |
|
9. แอลกอฮอล์ |
ของเหลว |
เอทานอล |
เอทานอล |
|
10. ทิงเจอร์ไอโอดีน |
ของเหลว |
เอทานอล |
เอทานอล |
|
11. อากาศ |
แก๊ส |
แก๊สไนโตรเจน |
แก๊สไนโตรเจน |
|
12. แก๊สหุงต้ม |
แก๊ส |
โพรเพน |
|
สารเนื้อผสม
สารเนื้อผสม คือ สารที่มีองค์ประกอบมากกว่าหนึ่งส่วน สารที่มองไม่เป็นเนื้อเดียวหรือองค์ประกอบเดียว แต่จะสามารถเห็นเป็น 2 องค์ประกอบขึ้นไป
– สารเนื้อผสม แบ่งเป็น คอลลอยด์ และสารแขวนลอย
– สารผสม แบ่งเป็น สารละลาย คอลลอยด์ และสารแขวนลอย
– สารแขวนลอย คือ สารผสมที่ประกอบด้วยสารที่อนุภาคมีเส้นผ่านศูนย์กลางยาวกว่า 10-4 เซนติเมตร กระจายอยู่ในสารที่เป็นตัวกลางอีกชนิดหนึ่ง เมื่อทิ้งไว้จะตกตะกอน สามารถที่จะแยกอนุภาคในสารแขวนลอยได้โดยการใช้กระดาษกรอง
– คอลลอยด์ คือ สารผสมที่ประกอบด้วยสารที่อนุภาคมีเส้นผ่านศูนย์กลางระหว่าง 10-4 – 10-7 เซนติเมตร กระจายอยู่ในสารที่เป็นตัวกลางอีกชนิดหนึ่ง สามารถที่จะแยกอนุภาคในคอลลอยด์ออกจากตัวกลางได้โดยการใช้กระดาษเซลโลเฟนเท่านั้น ไม่สามารถใช้กระดาษกรองในการแยกอนุภาคได้เนื่องจากอนุภาคของคอลลอยด์มีขนาดเล็กกว่ารูของกระดาษกรอง
สรุปข้อแตกต่างระหว่างสารผสมกับสารเนื้อผสม
ข้อแตกต่างระหว่างสารผสมกับสารเนื้อผสม คือ สารผสมมีองค์ประกอบตั้งแต่ 2 ส่วนขึ้นไป ซึ่งอาจจะมองเห็นเพียงส่วนเดียวหรือหลายส่วนก็ได้ (ส่วนเดียว คือ มองเห็นเป็นเนื้อเดียว ได้แก่ สารละลาย หลายส่วน คือ มองเห็นเป็นเนื้อผสม ได้แก่ คอลลอยด์ และสารแขวนลอย)
– สารผสม ต่างก็เป็นสารไม่บริสุทธิ์ มีความแตกต่างกันในเรื่องขนาดของอนุภาค
– สารแขวนลอย มีขนาดเส้นผ่านศูนย์กลางของอนุภาคมากกว่า 10-4 เซนติเมตร
ตัวอย่างสารแขวนลอย
– คอลลอยด์ มีขนาดเส้นผ่านศูนย์กลางของอนุภาคอยู่ระหว่าง 10-4 – 10-7 เซนติเมตร
ตัวอย่างคอลลอยด์
– สารละลาย มีขนาดเส้นผ่านศูนย์กลางของอนุภาคเล็กกว่า 10-7 เซนติเมตร
# วิธีการตรวจสอบสารผสมทั้ง 3 ชนิด ทำได้หลายวิธี ดังนี้
วิธีที่ 1
ตั้งสารตัวอย่างที่ต้องการตรวจสอบไว้ แล้วถ้าตกตะกอนก็แสดงว่า สารตัวอย่างนั้นเป็นสารแขวนลอย (อนุภาคขนาดใหญ่ มวลจึงมาก ทำให้ตกตะกอน)
วิธีที่ 2
ทดสอบโดยใช้วิธีการกรองผ่านกระดาษกรองและกระดาษเซลโลเฟน ซึ่งกระดาษกรองสามารถกรองสารที่มีเส้นผ่านศูนย์กลางใหญ่กว่า เซนติเมตรขึ้นไป และกระดาษเซลโลเฟนซึ่งสามารถกรองสารที่มีขนาดเส้นผ่านศูนย์กลางใหญ่กว่า เซนติเมตร
#สรุปผลการทดสอบ
1. สารแขวนลอย ไม่สามารถผ่านทั้งกระดาษกรองและกระดาษเซลโลเฟนได้ (อนุภาค > เซนติเมตร)
2. คอลลอยด์ ผ่านกระดาษกรองได้ แต่ไม่สามารถผ่านกระดาษเซลโลเฟนได้ (เซนติเมตร > อนุภาค > เซนติเมตร)
3. สารละลาย ผ่านได้ทั้งกระดาษกรองและกระดาษเซลโลเฟน (อนุภาค < เซนติเมตร)
ข้อควรทราบ
คอลลอยด์มีลักษณะพิเศษกว่าสารผสมประเภทอื่นๆ คือ สามารถเกิด “ปรากฏการณ์ทินดอลล์ (Tyndall Effect)”
ปรากฏการณ์ทินดอลล์ ค้นพบโดย จอห์น ทินดอลล์ (John Tyndall) นักวิทยาศาสตร์ชาวไอร์แลนด์ ในปี พ.ศ. 2412
ปรากฏการณ์ทินดอลล์ คือ แสงกระทบอนุภาคของคอลลอยด์จะเกิดการกระเจิงแสง ทำให้มองเห็นเป็นลำแสงในคอลลอยด์นั้น โดยแสงไม่สามารถทะลุผ่านคอลลอยด์ได้
# ประเภทของคอลลอยด์
1. เจล (gel) เป็นคอลลอยด์ที่เกิดจากสารที่มีสถานะเป็นของแข็ง เป็นสารที่มีโมเลกุลขนาดใหญ่ ซึ่งกระจายอยู่ในสารที่เป็นตัวกลางที่มีสถานะเป็นของเหลว และมักจะมีลักษณะที่มีความเหนียวหนืด เช่น กาวลาเท็กซ์ แป้งเปียก แยมผลไม้ต่างๆ เยลลี่ เป็นต้น
2. โฟม (foam) เป็นคอลลอยด์ที่อาจเกิดจากแก๊สที่กระจายอยู่ในของแข็งและของเหลวได้
3. แอโรซอล (aerosol) เป็นคอลลอยด์ที่อาจจะเกิดจากสารที่มีสถานะเป็นของแข็งหรือของเหลวที่กระจายอยู่ในแก๊สได้
– ของแข็งที่กระจายอยู่ในแก๊ส เช่น ฝุ่นละอองที่กระจายอยู่ในอากาศ กลุ่มควัน เป็นต้น
– ของเหลวที่กระจายอยู่ในแก๊ส เช่น สเปรย์ปรับอากาศ ยาฆ่าแมลงชนิดสเปรย์ เป็นต้น
4. อิมัลชัน (emulsion) เป็นคอลลอยด์ที่เกิดจากสารที่มีสถานะเป็นของเหลว และไม่รวมกันเป็นเนื้อเดียว ถูกทำให้รวมกันโดยการเติมสารที่เป็นอิมัลซิฟายเออร์ ซึ่งเป็นตัวประสานให้ของเหลวทั้งสองรวมตัวกัน เกิดเป็นสารที่เรียกว่า อิมัลชัน เช่น
– น้ำมันผสมกับน้ำ มีน้ำสบู่เป็นอิมัลซิฟายเออร์
– น้ำสลัด (น้ำมันพืช น้ำส้มสายชู) มีไข่แดงเป็นอิมัลซิฟายเออร์
ข้อควรทราบ
– ของเหลวที่ไม่รวมตัวกัน มารวมตัวกันได้ เรียกว่า อิมัลชัน (emulsion)
– สารที่ทำให้เกิดการประสานรวมกัน เรียกว่า อิมัลซิฟายเออร์ (emulzifier)
5. ซอล (sol) เป็นคอลลอยด์ที่เกิดจากสารที่มีสถานะเป็นของแข็ง มีโมเลกุลขนาดเล็กกระจายอยู่ในสารที่เป็นตัวกลางที่มีสถานะเป็นของเหลว เช่น น้ำแป้ง น้ำอบไทย เป็นต้น
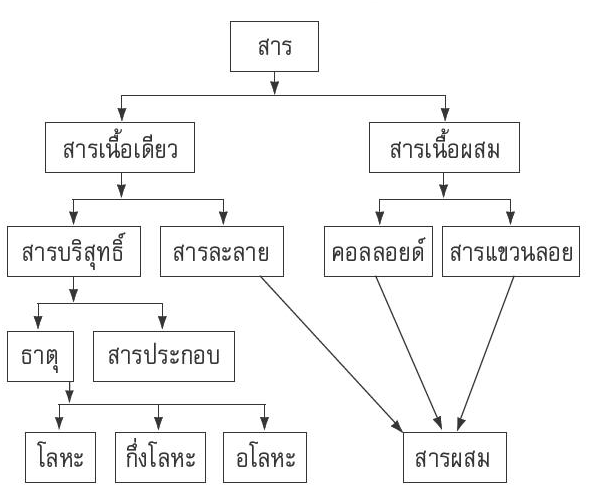
แผนผังแสดงประเภทของสาร
การตรวจสอบสารบริสุทธิ์และสารละลาย
วิธีที่ 1
นำสารไประเหย โดยการให้ความร้อน (การระเหย คือ การทำให้สารเปลี่ยนสถานะจากของเหลวกลายเป็นแก๊ส)
ผลที่เกิดขึ้น ถ้ามีของแข็งเหลืออยู่แสดงว่า มีองค์ประกอบ 2 ส่วนขึ้นไปโดยมีสถานะแตกต่างกัน (ของแข็งในของเหลว) แสดงว่าเป็นสารละลาย
ผลที่เกิดขึ้น ถ้าไม่มีสารใดเหลืออยู่ แสดงว่า อาจเป็นสารบริสุทธิ์ที่มีองค์ประกอบเดียวหรือเป็นสารละลายที่มีองค์ประกอบสถานะเดียวกัน (ของเหลวทั้งตัวทำละลายและตัวละลาย) ดังนั้น จึงสรุปไม่ได้ว่าเป็นสารประเภทใด
วิธีที่ 2
นำสารที่ต้องการตรวจสอบไปหาจุดเดือด (สารนั้นต้องเป็นของเหลว)
ผลที่เกิดขึ้น หากจุดเดือดคงที่ สารนั้นคือสารบริสุทธิ์ แต่ถ้าจุดเดือดของสารนั้นไม่คงที่ สารนั้นคือ
สารละลาย ซึ่งเมื่อนำอุณหภูมิกับเวลามาเขียนกราฟจะเห็นความแตกต่าง ดังนี้
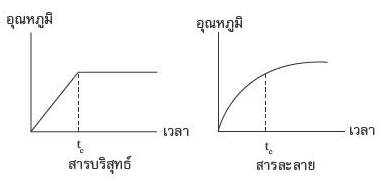
วิธีที่ 3
ถ้าสารที่นำมาตรวจสอบเป็นของแข็ง มีวิธีการตรวจสอบ คือ นำไปหาจุดหลอมเหลว (จุดหลอมเหลว การเปลี่ยนสถานะของสารจากของแข็งเป็นของเหลว ช่วงการหลอมเหลวคืออุณหภูมิตั้งแต่เริ่มละลายจนสารนั้นละลายหมด)
ผลที่เกิดขึ้น
1) ช่วงการหลอมเหลวกว้าง สารนั้นเป็นสารละลาย
2) ช่วงการหลอมเหลวแคบ สารนั้นเป็นสารบริสุทธิ์
การแยกสารเนื้อเดียวและสารเนื้อผสม
การแยกสาร หมายถึง การที่แยกสารที่ผสมกันตั้งแต่ ๒ ชนิดขึ้นไปออกจากกัน เพื่อนำสารที่ได้นั้นไปใช้ประโยชน์ตามต้องการ ซึ่งสามารถจำแนกได้คือ การแยกสารเนื้อผสม และการแยกสารเนื้อเดียว
สารเนื้อผสม หมายถึง สารที่มีลักษณะเนื้อสารไม่ผสมกลมกลืนกันเป็นเนื้อเดียวกันเกิดจาก
สารอย่างน้อย 2 ชนิดขึ้นไปมาผสมกันโดยเนื้อสารจะแยกกันเป็นส่วน ๆ
การแยกสารเนื้อผสมอาจใช้วิธีการต่าง ๆ เช่น การกรอง การใช้กรวยแยก การใช้อำนาจแม่เหล็ก การระเหิด การระเหยจนแห้ง ซึ่งเป็นการแยกสารโดยวิธีทางกายภาพทั้งสิ้น สารที่แยกได้จะมีสมบัติเหมือนเดิม
1. การกรอง
เป็นวิธีการแยกสารออกจากกันระหว่างของแข็งกับของเหลว หรือใช้แยกสารแขวนลอยออกจากน้ำ ซึ่งใช้กันมากในทางเคมี โดยเฉพาะในห้องปฏิบัติการที่กรองสารในปริมาณน้อย ๆ การกรองนั้นจะต้องเทสารผ่านกระดาษกรอง อนุภาคของแข็งที่ลอดผ่านรูกระดาษกรองไม่ได้จะอยู่บนกระดาษกรอง ส่วนน้ำและสารที่ละลายน้ำได้จะผ่านกระดาษกรองลงสู่ภาชนะ
2. การใช้กรวยแยก
เป็นวิธีที่ใช้แยกสารเนื้อผสมที่เป็นของเหลว 2 ชนิดที่ไม่ละลายออกจากกัน โดยของเหลวทั้งสองนั้นแยกเป็นชั้นเห็นได้ชัดเจน เช่น น้ำกับน้ำมัน เป็นต้น การแยกโดยวิธีนี้จะนำของเหลวใส่ในกรวยแยก แล้วไขของเหลวที่อยู่ในชั้นล่างซึ่งมีความหนาแน่นมากกว่าชั้น
บนออกสู่ภาชนะจนหมด แล้วจึงค่อย ๆ ไขของเหลวที่ที่เหลือใส่ภาชนะใหม่
3. การใช้อำนาจแม่เหล็ก
เป็นวิธีที่ใช้แยกองค์ประกอบของสารเนื้อผสมซึ่งองค์ประกอบหนึ่งมีสมบัติในการถูกแม่เหล็กดูดได้ เช่น ของผสมระหว่างผงเหล็กกับผงกำมะถัน โดยใช้แม่เหล็กถูไปมาบนแผ่นกระดาษที่วางทับของผสมทั้งสอง แม่เหล็กจะดูดผงเหล็กแยกออกมา
4. การระเหิด
คือ ปรากฏการณ์ที่สารเปลี่ยนสถานะจากของแข็งกลายเป็นก๊าซหรือไอโดยไม่เปลี่ยนสถานะเป็นของเหลวก่อน ใช้แยกสารเนื้อผสมที่เป็นของแข็งออกจากกัน โดยของแข็งชนิดหนึ่งมีสมบัติระเหิดได้ เช่น ลูกเหม็น พิมเสน น้ำแข็งแห้ง การบูรกับเกลือแกง เมื่อให้ความร้อนการบูรจะกลายเป็นไอแยกออกจากเกลือแกง ดักไอของการบูรด้วยภาชนะที่เย็นจะได้การบูรเป็นของแข็งแยกออกมา
5. การใช้มือหยิบออกหรือเขี่ยออก
ใช้แยกของผสมเนื้อผสม ที่ของผสมมีขนาดโตพอที่จะหยิบออกหรือเขี่ยออกได้ เช่น ข้าวสารที่มีเมล็ดข้าวเปลือกปนอยู่
6. การตกตะกอน
ใช้แยกของผสมเนื้อผสมที่เป็นของแข็งแขวนลอยอยู่ในของเหลว ทำได้โดยนำของผสมนั้นวางทิ้งไว้ให้สารแขวนลอยค่อย ๆ ตกตะกอนนอนก้น ในกรณีที่ตะกอนเบามากถ้าต้องการให้ตกตะกอนเร็วขึ้นอาจทำได้โดย ใช้สารตัวกลางให้อนุภาคของตะกอนมาเกาะ เมื่อมีมวลมากขึ้น น้ำหนักจะมากขึ้นจะตกตะกอนได้เร็วขึ้น เช่น ใช้สารส้มแกว่ง อนุภาคของสารส้มจะทำหน้าที่เป็นตัวกลางให้โมเลกุลของสารที่ต้องการตกตะกอนมาเกาะ ตะกอนจะตกเร็วขึ้น
การแยกาสารเนื้อเดียว
สารเนื้อเดียว เป็นสารทีเกิดขึ้นโดยทั่วไป มองเห็นเป็นเนื้อเดียวกันโดยตลอด แบ่งเป็นพวก ได้แก่ ธาตุ สารละลาย และสารประกอบ ในการแยกสารเนื้อเดียวที่อยู่ในรูปของสารละลายนั้น สามารถทำได้โดยวิธีการดังต่อไปนี้
1. การระเหยจนแห้ง
ใช้ในกรณีที่ตัวถูกละลายเป็นของแข็งและตัวทำละลายเป็นของเหลว หรือของแข็งละลายในของเหลว เช่น เมื่อนำเกลือแกงซึ่งเป็นของแข็งมาละลายในน้ำจะได้ของผสมเนื้อเดียวกัน เรียกว่า สารละลายเกลือแกง ในกรณีที่เราต้องการแยกเกลือแกงและน้ำออกจากสาระลายเกลือแกงทำได้โดยการนำสารดังกล่าวมาให้ความร้อน เพื่อระเหยตัวละลาย ในที่นี้คือน้ำออกไป สิ่งที่เหลืออยู่ในภาชนะคือตัวถูกละลาย ที่เป็นของแข็งในที่นี้คือ เกลือแกง
2. โครมาโตกราฟี (Chromatography)
เป็นเทคนิคการแยกสารเนื้อเดียวออกจากกันให้เป็นสารบริสุทธิ์ โดยอาศัยหลักการที่ว่า “สารแต่ละชนิดมีความสามารถในการละลายต่างกัน และถูกดูดซับต่างกัน จึงทำให้สารแต่ละชนิดแยกออกจากกันได้” ดังนั้นการแยกสารด้วยเทคนิคโครมาโตกราฟี จึงต้องอาศัยสมบัติของสารดังนี้
2.1 สารต่างชนิดกันมีความสามารถในการละลายในตัวทำละลายชนิดเดียวกันได้ดี ไม่เท่ากัน สารที่ละลายได้ดีจะเคลื่อนที่ไปได้เร็ว
2.2 สารต่างชนิดกันถูกดูดซับโดยตัวดูดซับได้ดีไม่เท่ากันสารที่ถูกดูดซับได้ดีจะเคลื่อนที่ได้ช้า
2.3 สารที่ละลายในตัวทำละลายได้ดี และถูกดูดซับน้อยจะเคลื่อนที่ได้เร็วไปได้ไกล
2.4 สารที่ละลายในตัวทำละลายได้น้อยและถูกดูดซับมากจะเคลื่อนที่ช้าไปได้ไม่ไกล
ประโยชน์ของโครมาโตกราฟี
1. ใช้ในการแยกสารเนื้อเดียวที่มีส่วนผสมหลาย ๆ ชนิด ให้ได้เป็นสารบริสุทธิ์
2. ใช้ในการวิเคราะห์หาปริมาณและชนิดของสาร
3. ใช้ทดสอบหรือแยกสารตัวอย่างที่มีปริมาณน้อย ๆ ได้
4. ใช้แยกสารได้ทั้งสารที่มีสีและไม่มีสี
3. การกลั่น
เป็นกระบวนการที่ทำให้ของเหลวได้รับความร้อนจนกลายเป็นไอ ทำให้แยกตัวทำละลายและตัวถูกละลายที่ต่างก็เป็นของเหลวออกจากกันได้โโยอาศัยความแตกต่างกันของจุดเดือด การกลั่นจะใช้ได้ผลต่อเมื่อตัวทำละลายและตัวถูกละลายเดือดที่อุณหภูมิต่างกันค่อนข้างมาก(ต่างกันอย่างน้อย 20 ๐C) เช่น การแยกน้ำจากน้ำทะเล การแยกน้ำจากน้ำคลอง การแยกน้ำจากน้ำเกลือ หรือน้ำเชื่อม เป็นต้น
4. การตกผลึก
เป็นกระบวนการแยกของแข็งที่ละลายในตัวทำละลายที่เป็นของเหลว โดยทำให้สารละลายอิ่มตัวที่อุณหภูมิสูง แล้วปล่อยให้สารละลายเย็นลง ของแข็งจะตกผลึกออกมา
การแยกสารเป็นการ
1. การกรอง เป็นการแยกสารเนื้อผสมด้วยกระบวนการแยกของแข็งที่ไม่ละลายในของเหลวออกจากของเหลว
2. การกลั่น
3. การระเหิด
4. การสกัดด้วยตัวทำลาย
สารรอบตัวมีสถานะของแข็ง ของเหลวและก๊าซ สารบางชนิดถ้าสังเกตด้วยตาเปล่า จะมองเห็นเป็นสารเนื้อเดียวกัน เช่น สารละลายไอโอดีน สารบางชนิดถ้ามองด้วยตาเปล่าจะสามารถเห็นเนื้อสารแยกออกมาอย่างชัดเจน เช่น ขมิ้นกับปูน แต่สารบางชนิดไม่สามารถใช้การสังเกตด้วยตาเปล่าแยกเนื้อสารได้
วิธีในการแยกสารส่วนมากที่ใช้กัน ได้แก่ การกลั่น การสกัดโดยการกลั่นด้วยไอน้ำ การสกัดด้วยตัวทำละลาย วิธีโครมาโทรกราฟี การตกผลึก การกรอง การใช้กรวยแยก การระเหยแห้ง
วิธีการแยกสาร
การระเหย (Evaporation) ใช้กับสารละลายที่มีของแข็งที่ระเหยยาก อยู่ในตัวทำละลายที่ระเหยง่าย สามารถแยกออกโดยใช้ความร้อน ดังนี้ คือ ให้ความร้อนกับสานละลายโดยไม่ต้องควบคุมอุณหภูมิ เมื่อสารละลายงวดลง ต้องหยุดให้ความร้อนแล้วปล่อยให้สารละลายนั้นแข็งตัวตกผลึก
การตกผลึก (Crystallization) เป็นวิธีการที่ทำให้สารบริสุทธ์วิธีหนึ่งที่ใช้กัน เพราะของแข็งแต่ละชนิดมีความสามารถในการละลาย ณ อุณหภูมิหนึ่งไม่เท่ากัน เมื่อสารใดถึงจุดอิ่มตัวก่อนสารนั้นจะตกผลึกออกมาก่อน จึงควรเลือกตัวทำละลายให้เหมาะสมกับสารนั้น นั่นคือควรละลายสารผสมให้ได้มากที่สุดในตัวทำละลายที่ร้อน จากนั้นทำให้เย็นแล้วจึงนำไปกรองด้วยกระดาษกรอง
การกรอง (Filltration) เป็นวิธีแยกสารที่เป็นของแข็งที่ไม่ละลายในของเหลวโดยใช้ กระดาษกรองในการแยกสารละลาย
การกลั่น (Distillation) เป็นกระบวนการที่ทำให้ของเหลวที่ประกอบด้วยตัวทำละลายและตัวถูกละลายได้รับความร้อนจนกลายเป็นไอ เมื่อกระทบกับความเย็นจะเกิดการเปลี่ยนสถานะกลายเป็นของเหลว การเปลี่ยนสถานะของสารจากก๊าซกลายเป็นของเหลว เรียกว่า การควบแน่น ทำให้แยกตัวทำละลายและตัวถูกละลายที่เป็นของเหลวออกจากกันโดยอาศัยความแตกต่างของจุดเดือด การกลั่นจะใช้ได้ผลเมื่อตัวทำละลายและตัวถูกละลายเดือดที่อุณหภูมิต่างกันค่อนข้างมาก
ปัจจุบัน ได้มีการณรงค์ในเรื่องการนำสารหรือผลิตภัณฑ์พื้นบ้านมาใช้ประโยชน์ เช่น พืชสมุนไพรบางชนิดได้แก่ ขิง ข่า เป็นต้น เพื่อประหยัดการนำเข้าสินค้าจากต่างประเทศ
การสกัดด้วยตัวทำละลาย (Solvent Extration) ใช้แยกสารเนื้อเดียวที่เป็นของแข็งกับของแข็ง หรือของเหลวกับของเหลวได้โดยอาศัยสมบัติการละลายเป็นตัวสำคัญ ดังนั้นจึงต้องเลือกตัวทำละลายให้เหมาะสม เพื่อสกัดสารที่ต้องการให้ได้มากที่สุด และสกัดสารที่ไม่ต้องการให้ได้น้อยที่สุด
การสกัดโดยการกลั่นด้วยไอน้ำ(Steam Distilation) สารที่ต้องการสกัดต้องระเหยได้ง่าย สามารถให้ไอน้ำพาออกมาได้ สารที่สกัดได้ต้องไม่รวมเป็นเนื้อเดียวกับน้ำหรือต้องไม่ละลายน้ำ ถ้ารวมกับน้ำต้องเสียเวลากลั่นอีก สารที่กลั่นได้จะอยู่รวมกับน้ำเป็น 2 ชั้น แยกออกได้โดยใช้กรวยแยก
โครมาโทรการฟี (Chromatography) เป็นเทคนิคอย่างหนึ่งที่ใช้แยกสารผสมออกจากกันให้บริสุทธิ์ เทคนิคนี้เริ่มใช้ครั้งแรกในปี พ.ศ. 2449 โดยนักพฤกษศาสตร์ชาวรัสเซีย ชื่อมิเชล สเวต คำว่า โครมาโทกราฟี หมายถึงการแยกสีที่ผสมออกจากกัน แต่ปัจจุบันสามารถพัฒนามาใช้แยกสารไม่มีสีได้ และใช้ได้แม้สารนั้นมีเพียงเล็กน้อย
หลักการสำคัญของโครมาโทรการฟี คือ สารใดในของผสมละลายในตัวทำละลายที่ใช้ได้ดีจะเคลื่อนที่ไปกับตัวทำละลายได้ไกล หรือดูดซับไว้ได้มากหรือได้ดี ระยะทางการเคลื่อนที่ของตัวถูกละลายแต่ละชนิดกับระยะทางการเคลื่อนที่ของตัวทำละลายที่เท่ากัน เมื่อนำมาเปรียบเทียบในแต่ละชนิดของตัวถูกละลายจะเห็นความแตกต่างกัน อัตราส่วนที่ได้เรียกว่า Rate of Flow Values หรือย่อว่า Rf
คำว่า Rf ขึ้นอยู่กับชนิดของตัวทำละลาย ชนิดของตัวดูดซับ สภาวะ เช่น อุณหภูมิ ความกดดัน ความชื้นในอากาศ ความสามรถในการละลายของสารบริสุทธ์กับตัวทำละลายที่นำมาใช้ค่าRf ของสารชนิดหนึ่งในตัวทำละลายอย่างหนึ่งมีค่าคงที่ ดังนั้น เมื่อระบุ Rf ของสารใดต้องบอกชนิดของตัวทำละลายที่ใช้และภาวะที่ใช้ด้วย
ถ้าองค์ประกอบที่เคลื่อนที่บนตัวดูดซับ เคลื่อนที่ไปได้เท่า ๆ กันหรือ ใกล้เคียงกันต้องแก้ไขโดยเพิ่มระยะทางให้ไกลออกไปจากจุดเริ่มต้นหรือเปลี่ยนตัวทำละลายใหม่ เมื่อแบ่งเทคนิคโครมาโทรกราฟตามลักษณะตัวดูดซับและตัวทำละลายมี 4 แบบคือ
1) โครมาโทรการาฟีแบบกระดาษ
2) โครมาโทรการาฟแบบหลอดแก้วหรือแบบคอลัมน์
3) โครมาโทรการาฟีแบบเยื่อบาง
4) โครมาโทรการาฟแบบก๊าซ – ของเหลว
วิธีโครมาโทรกราฟีใช้ประโยชน์ทั้งทางปริมาณวิเคราะห์ และคุณภาพวิเคราะห์ในกรณีที่ใช้กับสารไม่มีสี อาจตรวจดดยส่องด้วยรังสีอัลตราไวดอเลต (UV) ถ้าสารนั้นเรืองแสงหรือพ่นด้วยไอดอดีนบนตัวดูดซับในภาชนะปิด สารบางชนิดเมื่อถูกไอโอดีนจะให้สีน้ำตาลหรือพ่นนินไฮอดริน (Ninhydrin) ถ้าสารนั้นมีกรดอะมิโนจะได้สีน้ำเงินปนม่วง
ข้อดีของเทคนิคโครมาโทรกราฟี
ใช้แยกสารตัวอย่างที่มีปริมาณน้อยได้โดยใช้ตัวดูดซับ
ใช้ได้ทั้งปริมาณวิเคราะห์ และคุณภาพวิเคราะห์ได้
แยกได้ทั้งสารมีสีและสารไม่มีสี
เมื่อนักเรียนได้ศึกษาวิธีการแยกสารดังกล่าว นักเรียนจะพบว่าการแยกสารแต่ละวิธีอาศัยสมบัติของสารแต่ละชนิดเป็นสำคัญ หากเรามีสารรอบตัวมากมาย ที่เป็นประโยชน์หรืออาจก่อให้เกิดโทษต่อมนุษย์และสิ่งแวดล้อม ถ้าเราได้นำความรู้ในเรื่องการแยกสารมาใช้ให้ถูกวิธีและเหมาะสม เราก็สามารถได้สารที่เป็นประโยชน์มาใช้ในชีวิตประจำวัน และคัดเลือกสารที่ไม่ต้องการหรืออาจก่อให้เกิดโทษต่อมนุษย์ และสิ่งแวดล้อมโดยอาศัยวิธีการแยกสารได้






