ของเหลว
ของเหลว หมายถึง สารที่มีแรงยึดเหนี่ยวระหว่างอนุภาคน้อยกว่าของแข็ง ทำให้อนุภาคไม่ได้อยู่ชิดกันอย่างของแข็ง จึงมีปริมาตรที่แน่นอน แต่มีรูปร่างไม่แน่นอน เปลี่ยนแปลงไปตามลักษณะของภาชนะที่บรรจุ เช่น น้ำ เบนซีน และปรอท เป็นต้น
สมบัติของของเหลว
1. ของเหลวมีปริมาตรคงที่ เนื่องจากโมเลกุลของของเหลวอยู่เป็นกลุ่ม ๆ อย่างไม่เป็นระเบียบ
โดยมีระยะห่างระหว่างกลุ่มเล็กน้อยและของเหลวมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากกว่าแก๊ส จึงทำให้โมเลกุลของของเหลวเ
คลื่อนที่ได้ระยะทางใกล้ ๆ ไม่สามารถเคลื่อนที่ได้อย่างอิสระเหมือนแก๊ส จึงทำให้ของเหลวมีปริมาตรคงที่ไม่สามารถฟุ้งกระจาย
เต็มภาชนะ (มีปริมาตรเท่ากับภาชนะบรรจุ) เหมือนแก๊ส ปริมาตรของของเหลวเปลี่ยนแปลงเล็กน้อยเมื่อเปลี่ยนความดันและอุณหภูมิ
2. ของเหลวมีรูปร่างไม่คงที่ (รูปร่างเหมือนภาชนะบรรจุ) เนื่องจากโมเลกุลของของเหลวอยู่กันเป็นกลุ่ม ๆ
อย่างไม่เป็นระเบียบและมีที่ว่างระหว่างกลุ่ม ถ้าโมเลกุลของของหลวมีการเคลื่อนที่ภายในที่ว่างระหว่างกลุ่มทำให้รูปร่างของของเหลวเปลี่ยนแปลงได้
2.1 ของเหลวมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากกว่าแก๊ส แต่น้อยกว่าของแข็ง
2.2 ของเหลวสามารถเกิดการแพร่ได้ในอัตราที่ช้ากว่าแก๊ส
2.3 ของเหลวมีความหนาแน่นมากกว่าแก๊สแต่น้อยกว่าของแข็ง
การเปลี่ยนสถานะของของเหลว
การระเหย (Evaporation) คือ การเปลี่ยนสถานะของสารจากของเหลวเป็นแก๊ส โดยที่การระเหย
สามารถเกิดได้ทุกอุณหภูมิและเกิดเฉพาะผิวหน้าของของเหลวเท่านั้น
ปัจจัยในการระเหย
1) อุณหภูมิ การเพิ่มอุณหภูมิทำให้โมเลกุลมีพลังงานจลน์สูงขึ้น โอกาสที่จะชนะแรงดึงดูดระหว่างโมเลกุลย่อมมีมากขึ้น
2) พื้นที่ผิวของของเหลว ทำให้โมเลกุลที่มีพลังงานจลน์สูงอยู่ที่ผิวมากขึ้นมีโอกาสหลุดออกจากแรงดึงดูดระหว่างโมเลกุลได้มากขึ้น
3) การที่ของเหลวอยู่ในระบบเปิด เป็นการป้องกันมิให้มีโอกาสกลับมาควบแน่นได้อีกและไม่ให้มีความดันไอต่อต้านโมเลกุลที่จะระเหยออกไปอีก
4) ความดันของบรรยากาศเหนือของเหลว ถ้ามีความดันของบรรยากาศต่ำของเหลวย่อมระเหยได้ดีขึ้น
5) การถ่ายเทของอากาศ มีผลให้การระเหยดีขึ้น
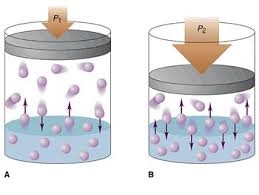
ความดันไอ
เมื่อใส่ของเหลวไว้ในระบบปิด โมเลกุลของของเหลวที่มีพลังงานมากและชนะแรงดึงดูดระหว่างโมเลกุลด้วยกัน ก็จะระเหยกลายเป็นไอ อยู่เหนือผิวของของเหลวนั้น โมเลกุลของไอที่อยู่เหนือผิวของเหลวนั้นจะชนกันเอง ชนกับผิวของภาชนะบ้าง และควบแน่นกลับมาเป็นของเหลวบ้าง เมื่อของเหลวระเหยกลายเป็นไอเพิ่มขึ้นจนถึงจำนวนหนึ่งจะทำให้ไอนั้นมีความดันค่าหนึ่งจนคงที่ ณ ความดันไอที่คงที่นี้จะมีจำนวนโมเลกุลของไอเหนือขงเหลวมีค่าเท่าเดิมอยู่ตลอดเวลา เรียกว่า ภาวะสมดุล ที่ภาวะสมดุล จำนวนโมเลกุลของของเหลวที่ระเหยไปเป็นไอ และจำนวนโมเลกุลของไอที่ควบแน่นกลับมาเป็นของเหลวเท่ากันตลอดเวลา ที่ภาวะสมดุลใด ๆ ที่ยังมีการเปลี่ยนแปลงกลับไปกลับมาได้ตลอดเวลา ด้วยอัตราเร็วเท่ากันและผลของการเปลี่ยนแปลง ระบบมีสมบัติคงที่ เรียกว่า สมดุลไดนามิก ความดันไอที่อยู่เหนือของเหลว ณ ภาวะสมดุลนี้เรียกว่า ความดันไอ ( Vapor pressure )
ปัจจัยที่มีผลต่อความดันไอ
1) แรงดึงดูดระหว่างโมเลกุลของของเหลว ถ้าสารที่มีแรงดึงดูดระหว่างโมเลกุลมากความดันไอจะต่ำ เพราะโอกาสที่โมเลกุลจะชนะแรงดึงดูดกลายเป็นไอนั้นยาก
2) อุณหภูมิ ถ้าอุณหภูมิของระบบสูง ย่อมทำให้โมเลกุลของสารมีพลังงานจลน์สูงขึ้นโอกาสที่จะระเหยกลายเป็นไอมีมากขึ้นความดันไอก็จะเพิ่มขึ้น
3) สารชนิดเดียวกัน ที่อุณหภูมิเท่ากันย่อมมีความดันไอเท่ากันเสมอไม่ว่าสารนั้นจะมีปริมาณมากหรือน้อยกว่ากัน นั่นคือ ความดันไอไม่ขึ้นอยู่กับปริมาตรของสาร
4) ความดันไอ จะเกิดขึ้นที่ภาวะสมดุลเท่านั้น ดังนั้นต้องพิจารณาในระบบปิดเสมอ
5) สารที่มีจุดเดือดต่ำ จะมีความดันไอสูง เพราะสารนั้นระเหยง่ายส่วนสารที่มีจุดเดือดสูงความดันไอจะต่ำเพราะสารนั้นระเหยยาก
4. จุดเดือด
การเดือด ( Boiling ) เป็นขบวนการที่โมเลกุลของของเหลวได้รับพลังงานสูงมากจนกลายเป็นไอได้อย่างรวดเร็ว และโมเลกุลของของเหลวทั่วทุกบริเวณในภาชนะนั้นสามารถที่จะหลุดหนีแรงดึงดูดระหว่างโมเลกุลได้อย่างรวดเร็ว การเดือดของของเหลวจะเกิดขึ้นที่อุณหภูมิหนึ่ง ซึ่งจะคงที่สำหรับของเหลวแต่ละชนิด เรียกว่า จุดเดือด ( Boiling point ) ความดันไอของของเหลวขณะเดือดจะมีค่าเท่ากับความดันภายนอกหรือมากกว่าซึ่งก็คือความดันบรรยากาศขณะนั้น ความดันของบรรยากาศจะมีผลต่อจุดเดือดของของเหลว คือ ถ้าเปลี่ยนความดันจะทำให้จุดเดือดของของเหลวเปลี่ยนไปด้วย ดังนั้นการบอกจุดเดือดของของเหลวชนิดหนึ่ง ๆ จะต้องบอกความดันของบรรยากาศด้วย เช่น จุดเดือดของน้ำเท่ากับ 100 องศาเซลเซียส ที่ความดัน 1 บรรยากาศ แต่โดยทั่วไปเมื่อกล่าวถึงจุดเดือดโดยไม่ระบุความดันเราหมายถึงจุดเดือดที่ความดัน 1 บรรยากาศ และเรียกว่า จุดเดือดปกติ
ขอบคุณแหล่งข้อมูล https://enchemcom2g.wordpress.com/liquids






