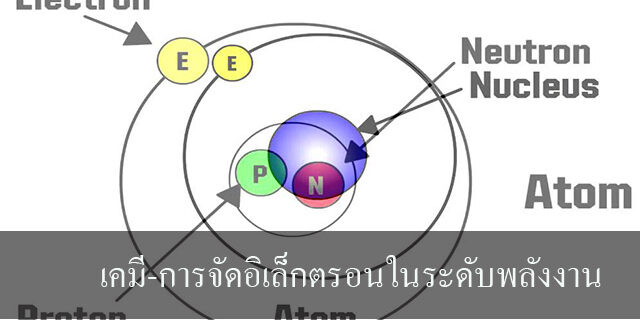
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ คือ K, L, M, N, O, P, Q ตามล้าดับ เมื่อ n = 1 จะเป็นระดับพลังงานต่ำสุด หมายความว่า จะต้องใช้พลังงานมากที่สุดที่จะดึงเอาอิเล็กตรอนนั้นออกจากอะตอมได้ จำนวนอิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8 เช่น
ระดับพลังงานที่หนึ่ง n = 1 (shell K) ปริมาณอิเล็กตรอนที่ควรมีอยู่ = 2(1)2 = 2
ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(2)2 = 8
ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(3)2 = 18
ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(4)2 = 32
ระดับพลังงานที่ห้า (n = 5) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(5)2 = 50
ระดับพลังงานที่หก (n = 6) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(6)2 = 72
ระดับพลังงานที่เจ็ด (n = 7) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(7)2 = 98
รูปที่ 1.1 ออร์บิทัล (orbital)
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1249
เช่น ตารางที่ 1.1 การจัดเรียงอิเล็กตรอนในระดับพลังงานหลักของธาตุต่างๆ

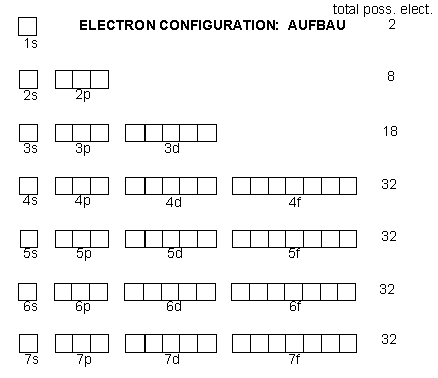
จากการศึกษาสเปกตรัมของธาตุต่างๆ พบว่าในระดับพลังงานหลัก (n) ยังประกอบด้วยระดับพลังงานย่อยหรือเรียกว่า ซับเซลล์ (sub-levels หรือ sub-shells) โดยก้าหนดเป็นสัญลักษณ์คือ s p d และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและมีพลังงานไม่เท่ากัน กล่าวคือ ระดับพลังงานย่อย s มีพลังงานต่ำกว่า p ต่ำกว่า d ต่ำกว่า f ตามล้าดับ ในระดับพลังงานย่อยยังประกอบด้วยออร์บิทัล (orbital) ซึ่งในแต่ละออร์บิทัลมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ดังนี้
ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1 ออร์บิทัล
ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
รูปที่ 1.2 แสดงระดับพลังงานในอะตอม
ที่มา : http://www.elecnet.chandra.ac.th/learn/courses/ELTC2103/energyband.html
จากการศึกษาพบว่ากรณีของอะตอมที่มีหลายอิเล็กตรอนนั้นระดับพลังงานของ 3d จะใกล้กับ 4s มาก และพบว่า ถ้าบรรจุอิเล็กตรอนใน 4s ก่อน 3d พลังงานรวมของอะตอมจะต่ำ และอะตอมจะเสถียรกว่า ดังนั้นในการจัดเรียงอิเล็กตรอนในออร์บิทัลแบบที่เสถียรที่สุด คือการจัดตามระดับพลังงานที่ต่ำที่สุดก่อนทั้งในระดับพลังงานหลักและย่อย ซึ่งวิธีการจัดอิเล็กตรอนสามารถพิจารณาตามลูกศรในรูปที่ 1.8 โดยเรียงลำดับได้เป็น 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p

รูปที่ 1.3 แสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัล
ที่มา : http://www.scimath.org/index.php/socialnetwork/viewbulletin/1189
ในการจัดอิเล็กตรอนอาจเขียนเป็นแผนภาพออร์บิทัลซึ่งแสดงสปินของอิเล็กตรอนด้วย ดังตัวอย่าง C มี z = 6 มีโครงแบบอิเล็กตรอนเป็น 1s2 2s2 2p2 ซึ่งการจัดแสดงสปินของอิเล็กตรอนแสดงในตารางที่ 1.1
ในการบรรจุอิเล็กตรอนหรือการจัดเรียงอิเล็กตรอนลงในออร์บิทัลจะต้องยึดหลักในการบรรจุอิเล็กตรอนของอะตอมหนึ่งๆ ลงในออร์บิทัลที่เหมาะสมตามหลักดังต่อไปนี้
1) หลักของเพาลี (Pauli exclusion principle) กล่าวว่า “ไม่มีอิเล็กตรอนคู่หนึ่งคู่ใดในอะตอมที่มีเลขควอนตัมทั้งสี่เหมือนกันทุกประการ” นั่นคืออิเล็กตรอนคู่หนึ่งในออร์บิทัลจะมีค่า n, ℓ, mℓ เหมือนกันได้ แต่ต่างกันที่สปิน
2) หลักของเอาฟ์บาว (Aufbau principle) มีวิธีการดังนี้
2.1) สัญลักษณ์วงกลม O, หรือ _ แทน ออร์บิทัล
ลูกศร ↑↓ แทน อิเล็กตรอน 1 ตัว ที่สปิน ขึ้น-ลง
↑↓ เรียกว่า อิเล็กตรอนคู่ (paired electron)
↑ เรียกว่าอิเล็กตรอนเดี่ยว (single electron)
2.2) บรรจุอิเล็กตรอนเข้าไปในออร์บิทัลที่มีระดับพลังงานต่ำจนครบจำนวนก่อน ดังรูปที่ 1.1
3) กฎของฮุนด์ (Hund’s rule) กล่าวว่า “การบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน (degenerate orbital) จะบรรจุในลักษณะที่ท้าให้มีอิเล็กตรอนเดี่ยวมากที่สุดเท่าที่จะมากได้” ออร์บิทัลที่มีระดับพลังงานมากกว่า 1 เช่น ออรฺบิทัล p และ d เป็นต้น
รูปที่ 1.4 โครงแบบอิเล็กตรอน (แบบสัญลักษณ์) ของธาตุ
ที่มา : http://www.vcharkarn.com/lesson/view.php?id=1168
4) การบรรจุเต็ม (filled configuration) เป็นการบรรจุอิเล็กตรอนในออร์บิทัลที่มีระดับพลังงานเท่ากัน แบบเต็ม ครบ 2 ตัว ส่วนการบรรจุครึ่ง (half- filled configuration) เป็นการบรรจุอิเล็กตรอนลงในออร์บิทัลแบบครึ่งหรือเพียง 1 ตัว เท่านั้น ซึ่งการบรรจุทั้งสองแบบ (ของเวเลนซ์อิเล็กตรอน) จะทำให้มีความเสถียรมากกว่าตัวอย่างการบรรจุเต็ม เช่น

รูปที่ 1.5 การบรรจุอิเล็กตรอนในออรืบิทัลแบบเต็ม
ที่มา : http://www.satriwit3.ac.th/external_newsblog.php?links=1249
ตัวอย่างการจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18

รูปที่ 1.6 การจัดอิเล็กตรอนของธาตุเลขอะตอม 1 ถึง 18
ที่มา : http://atomand.blogspot.com/p/1.html
การจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
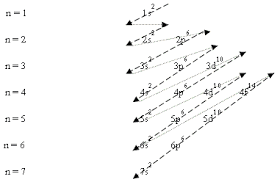
จากแผนภาพจัดเรียงอิเล็กตรอนเข้าสู่ระดับพลังงานย่อยได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
1.จัดอิเล็กตรอนในระดับพลังงานย่อยต่าง ๆ จะต้องจัดเข้าในระดับพลังงานย่อยที่มีพลังงานต่ำสุดก่อนแล้วจึงจัดเข้าสู่ระดับพลังงานย่อยที่มีพลังงานสูงขึ้น(ตามหลักของเอาฟบาว) ดังแผนผังต่อไปนี้
เช่น 17Cl มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1s2 2s2 2p6 3s2 3p5
21Se มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย
1s2 2s2 2p6 3s2 3p6 4s2 3d1
2. อิเล็กตรอน 2 ตัว ที่อยู่ในออร์บิทัลเดียวกัน จะต้องมีทิศทางการเคลื่อนที่สวนทางกันโดยแสดงทิศทางด้วยลูกศร
ตามหลักการของเพาลี
3. การจัดอิเล็กตรอนเข้าสู่ระดับพลังงานย่อย ถ้าอิเล็กตรอนบรรจุอยู่กึ่งหนึ่งหรือบรรจุเต็มออร์บิทัลจะมีโครงสร้างแบบเสถียร เช่น
24Cr มีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อย ดังนี้
1s2 2s2 2p6 3s2 3p6 4s1 3d5 ไม่ใช่ 1s2 2s2 2p6 3s2 3p6 4s2 3d4
เพราะโครงสร้างแบบแรกเสถียรกว่า เพราะ 4s และ 3d จะบรรจุกึ่งหนึ่ง
หรือเขียนโครงสร้างของอิเล็กตรอนแบบย่อ ๆ ได้ว่า (Ar) 4s1 3d5
ข้อสังเกตที่ได้จากการใช้จัดเรียงอิเล็กตรอนในอะตอม
1. เลขอะตอมคู่จะอยู่ในหมู่คู่ เลขอะตอมคี่จะเป็นธาตุในหมู่คี่ เช่น
ธาตุ 14Si จะเป็นธาตุในหมู่ 4
ธาตุ 11Na จะเป็นธาตุในหมู่ 1
2. ธาตุหมู่ IA และ IIA ตั้งแต่คาบ 3 ขึ้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 8 เสมอ เช่น
11Na จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 12Mg จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 2
19K จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 1 20Ca จะจัดเรียงอิเล็กตรอนเป็น 2, 8, 8, 2
3. ธาตุหมู่ IIIA ถึง VIIIA ตั้งแต่หมู่ที่ IIIA คาบ 4 เป็นต้นไป จะมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้นเป็น 18 เสมอ เช่น
31Ga 2, 8, 18, 3 (หมู่ 3 คาบ 4)
33As 2, 8, 18, 5 (หมู่ 5 คาบ 4)
4. ถ้าธาตุนั้นมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามข้อ 2 และ 3 คือมีจำนวนอิเล็กตรอนในระดับพลังงานถัดจากวงนอกสุดเข้ามา 1 ชั้น มีค่าตั้งแต่ 9 – 18 แต่วงนอกสุดมีเวเลนซ์อิเล็กตรอนเป็น 1หรือ 2 นักเรียนก็ทำนายได้ทันทีว่าเป็นธาตุแทรนซิชัน เช่น
29Cu 2, 8, 18, 1 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,18, 1
23V 2, 8, 8, 5 ไม่ใช่เป็นธาตุหมู่ 1 แต่เป็นธาตุแทรนซิชันจัดเรียงอิเล็กตรอนเป็น 2, 8,11, 2
หมายเหตุ ธาตุแทรนซิชันที่มีเลขอะตอมตั้งแต่ 21 – 30 จะมีเวเลนซ์อิเล็กตรอนเป็น 2 ยกเว้น Cu กับCr จะมีเวเลนซ์อิเล็กตรอนเป็น 1