ประมาณ 500 ปี ก่อนคริตศักราช นักปราชญ์กรีกชื่อ ดิโมเครตุส(Democritus) และลาซิปปุส(Leucippus) เชื่อว่าเมื่อย่อยสารลงเรื่อย ๆ จะได้ซึ่งไม่สามารถทำให้เล็กลงกว่าเดิมได้อีก และเรียกอนุภาคที่เล็กที่สุดว่า “อะตอม” (atom มาจากภาษากรีกคำว่า atomos แปลว่าแบ่งแยกอีกไม่ได้) และสิ่งที่เล็กที่สุดนี้ของแต่ละธาตุต่างกันจึงทำให้สมบัติต่าง ๆ ของแต่ละธาตุแตกต่างกันด้วย แต่ความเชื่อนี้ไม่ได้รับการยอมรับจากนักปราชญ์ที่มีชื่อเสียงในสมัยนั้น (Plato และ Aristotle)
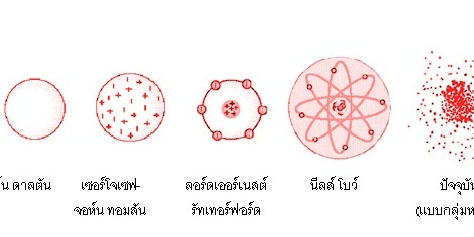
แบบจำลองอะตอมของดอลตัน
ในปี ค.ศ.1808 John Dalton ครูสอนวิทยาศาสตร์ คณิตศาสตร์ และนักปรัชญา ชาวอังกฤษ ได้เสนอแนวคิดเกี่ยวกับอะตอมที่เรียกว่าทฤษฎีอะตอม มีใจความสำคัญว่า
- สสารทุกชนิดประกอบด้วยอนุภาคที่เล็กที่สุด ซึ่งไม่สามารถแบ่งแยกต่อไปได้อีก เรียกว่า atom
- อะตอมของธาตุชนิดเดียวกัน ย่อมมีสมบัติเหมือนกันทุกประการ(เช่นมีมวลเท่ากัน) และมีสมบัติแตกต่างจากอะตอมของธาตุอื่น
- ไม่สามารถทำให้อะตอมสูญหายหรือเกิดใหม่ได้ (กฎทรงมวล Law of conservation mass)
- สารประกอบเกิดจากการรวมตัวทางเคมีระหว่างอะตอมของตั้งแต่สองชนิดขึ้นไป และจำนวนอะตอมของธาตุที่รวมตัวกันจะเป็นอัตราส่วนตัวเลขลงตัวน้อย ๆ (กฎสัดส่วนคงที่ Law of multipleproperties)
Dolton เสนอมโนภาพของแบบจำลองอะตอมว่า อะตอมมีลักษณะทรงกลมตัน มีขนาดเล็กมาก และไม่สามารถแบ่งแยกได้อีก
 ภาพที่ 1 แสดงแบบจำลองอะตอมของ Dolton
ภาพที่ 1 แสดงแบบจำลองอะตอมของ Dolton
ที่มา : http://thehistoryoftheatom.weebly.com/john-dalton.html
เมื่อนักวิทยาศาสตร์ได้ทำการทดลองค้นคว้าได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น พบว่าแบบจำลองอะตอมของ Dolton ไม่สามารถอธิบายได้ เช่น
- ทำไมอะตอมของธาตุต่างกันจึงมีมวลต่างกัน
- อะตอมของธาตุชนิดเดียวกันอาจมีสมบัติต่างกันได้ เช่น ไฮโดรเจนมี 3 ไอโซโทป 1H, 2H และ 3H เป็นธาตุชนิดเดียวกันแต่มีมวลต่างกัน
- ทำไมธาตุจึงมีความว่องไวในการเกิดปฏิกิริยาต่างกัน
- ทำไมธาตุหนึ่ง ๆ ทำปฏิกิริยาได้เฉพาะบางธาตุ
- อะตอมทำให้เกิดขึ้นใหม่หรือเปลี่ยนไปเป็นอะตอมของธาตุอื่นได้ หรือสามารถสังเคราะห์อะตอมของธาตุใหม่ได้โดยอาศัยปฏิกิริยานิวเคลียร์
ด้วยสาเหตุดังกล่าวจึงทำให้มีผู้ศึกษาค้นคว้าแบบจำลองอะตอมใหม่เพื่ออธิบายสิ่งที่เกิดขึ้น
แบบจำลองอะตอมของทอมสัน
Sir Joseph John Thomson นักวิทยาศาสตร์ชาวอังกฤษได้รวบรวมนำการศึกษาด้านต่าง ๆ ของผู้สนใจค้นคว้าในแต่ละสาขามารวมกันเป็นแบบจำลองอะตอมใหม่ เพื่ออธิบายปรากฏการณ์ที่แบบจำลองอะตอมของดอลตันไม่สามารถอธิบายได้ การทดลองที่สำคัญ คือ
- หลอดรังสีแคโทดของ William Crookers
- หลอดรังสีแคโทดของ Sir Joseph John Thomson
- การหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมันของ Robert Andrews Millikan
- หลอดรังสีแคโทดของ Eugen Goldstrin
- หลอดรังสีแคโทดของ William Crookers
จากปรากฏการณ์ธรรมชาติที่แสดงให้เห็นว่าแก๊สนำไฟฟ้าได้ คือ ปรากฏการณ์ฟ้าร้อง ฟ้าผ่า นักวิทยาศาสตร์จึงได้ทำการทดลองเพื่ออธิบายการนำไฟฟ้าของแก๊สพบว่า ที่ความดัน 1 บรรยากาศ (1 atm) อากาศจะไม่นำไฟฟ้า แต่ถ้าลดความดันลง และเพิ่มความต่างศักย์ระหว่างขั้วมาก ๆ แก๊สจะนำไฟฟ้าได้ดี
William Crookers ได้ประดิษฐ์อุปกรณ์เพื่อจำลองปรากฏการณ์ฟ้าร้อง ฟ้าผ่า ประกอบด้วยหลอดแก้วที่บรรจุแก๊สความดันต่ำ มีขั้วไฟฟ้าเป็นแผ่นโลหะ (Electrode) 2 ขั้ว ต่อเข้ากับเครื่องกำเนิดไฟฟ้าที่มีความต่างศักย์สูง (10,000 – 20,000 volte) แผ่นโลหะด้านไฟฟ้าลบเรียกว่า ขั้ว cathode แผ่นโลหะด้านไฟฟ้าบวกเรียกว่า ขั้ว anode และยังได้วางฉากเรืองแสง (ZnS ซิงค์ซัลไฟด์) ขนานไปตามแนวยาวของหลอด
จากการทดลองของ Crookers พบว่า
- ที่ความดัน 1 บรรยากาศ ไม่เห็นการเปลี่ยนแปลงใด ๆ
- เมื่อลดความดันลง แก๊สภายในหลอดแก้วจะเรืองแสง
- เมื่อลดความดันลงมาก ๆ บริเวณ anode จะเรืองแสงมาก
- เมื่อนำ หมุนได้ไปไว้ระหว่างขั้ว anode และ cathode ใบพัดจะหมุนได้
- เมื่อนำฉากเรืองแสง ZnS ไว้ระหว่างขั้ว anode และ cathode ฉากด้านที่หันไปทางขั้ว cathode เรืองแสงและเกิดเงา
เพราะฉะนั้นจึงสามารถกล่าวได้ว่ามีรังสีชนิดหนึ่งพุ่งออกมาจากขั้ว cathode เป็นเส้นตรงมายังขั้ว anode เรียกรังสีนี้ว่า cathode ray cathode ray ประกอบด้วยอนุภาคไฟฟ้าที่มีประจุลบและมีมวลเพราะสามารถทำให้ใบพัดของกังหันหมุนได้
- หลอดรังสีแคโทดของ Sir Joseph John Thomson
ค.ศ. 1897 (พ.ศ. 2440) Sir Joseph John Thomson นักวิทยาศาสตร์ชาวอังกฤษ ได้ดัดแปลงหลอดรังสีแคโทด พบว่าเมื่อลดความดันลงจนเกือบเป็นสูญญากาศ จะมีจุดสว่างบนฉากเรืองแสง Thomson จึงตั้งสมมุติฐานว่า รังสี cathode เป็นอนุภาคที่มีประจุ ดังนั้นอนุภาคควรจะเบี่ยงเบนในสนามแม่เหล็กและสนามไฟฟ้า
เมื่อนำสนามไฟฟ้าภายนอกมาล่อ จุดสว่างบนฉากเรืองแสงจะเบี่ยงเบนเข้าหาขั้วบวกเสมอ เพราะฉะนั้น Thomson จึงสรุปว่า รังสี cathode ประกอบด้วยอนุภาคลบที่เคลื่อนที่ออกจากขั้ว cathode ในลักษณะรังสี
Thomson ได้ทำการทดลองต่อโดย
- เปลี่ยนแก๊สภายในหลอดรังสี cathode โดยโลหะที่ทำขั้วยังคงเดิม พบว่าได้ผลการทดลองเช่นเดิม
- เปลี่ยนโลหะที่ใช้ทำขั้วเป็นโลหะชนิดต่าง ๆ แต่ใช้แก๊สชนิดเดิม พบว่าได้ผลการทดลองเช่นเดิม
สรุปได้ว่าไม่ว่าจะบรรจุแก๊สชนิดใดหรือใช้โลหะชนิดใดมาทำขั้ว หลอดรังสี cathode จะให้รังสี cathode ที่เป็นอนุภาคลบเหมือนกัน
Thomson ได้ทำการทดลองต่อโดยนำหลอดรังสี cathode วางไว้ในสนามแม่เหล็กและสนามไฟฟ้าที่ตั้งฉากกั้น จากนั้นค่อย ๆ เพิ่มอำนาจสนามแม่เหล็กจน รังสี cathode ไม่มีการเบี่ยงเบนแสดงว่าความแรงของสนามไฟฟ้ามีค่าเท่ากับความแรงสนามแม่เหล็ก Thomson อาศัยค่าความแรงของสนามแม่เหล็กและความแรงของสนามไฟฟ้าที่กระทำต่ออนุภาคลบในรังสี cathode หาอัตราส่วนประจุต่อมวล (e/m) ของอนุภาคได้ e/m = 1.759 x 108 คูลอมบ์ต่อกรัม
Thomson จึงสรุปว่า อนุภาคไฟฟ้าที่มีประจุลบเป็นองค์ประกอบของอะตอมของธาตุทุกชนิด และเรียกชื่ออนุภาคนี้ว่า อิเล็กตรอน (Electron)
- การหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมันของ Robert Andrews Millikan
ในปี ค.ศ.1909 (พ.ศ.2452) Robert Andrews Millikan นักวิทยาศาสตร์ชาวอเมริกัน ได้ทดลองหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมัน (Oil-drop experiment) เมื่อพ่นละอองเม็ดน้ำมันเข้าไปหยดน้ำมันจะเคลื่อนที่จากบนลงล่างตามแรงดึงดูดของโลกแต่เมื่อฉาย X-ray จะทำให้อากาศภาย (ในแตกตัวเป็นอนุภาคบวกและลบไปเกาะบนหยดน้ำมันที่มีประจุลบเท่านั้น) ดังนั้นเมื่อใส่สนามไฟฟ้าเข้าไปหยดน้ำมันที่มีประจุลบเกาะอยู่จะเคลื่อนที่ลงมาช้าลงเพราะขั้วบวกที่อยู่ด้านบนดึงดูดเอาไว้จากนั้นปรับสนามไฟฟ้าจนกระทั้งแรงดึงดูดจากสนามไฟฟ้า(ด้านบน)กับแรงดึงดูดของโลกมีค่าเท่ากันหยดน้ำมันจะลอยนิ่งนั้นคือ
จากสมการ F1 = mg (1)
เมื่อถ้า m = มวลของหยดน้ำมัน
g = แรงดึงดูดของโลก
F1 = แรงดึงดูดของโลกที่กระทำต่อหยดน้ำมัน
และจากสมการ F2 = Eq (2)
เมื่อ q = ประจุบนหยดน้ำมัน
E = สนามไฟฟ้า
F2 = แรงที่สนามไฟฟ้ากระทำต่อประจุบนหยดน้ำมัน
เมื่อหยดน้ำมันลอยนิ่ง สมการที่ 1 = สมการที่ 2
F1 = F2
mg = Eq
q = (mg) /E
ค่า m และ E หาได้จากเครื่องมือที่ใช้ Milikan พบว่าประจุบนเม็ดน้ำมันที่น้อยสุดว่ามีค่าเป็นเลขจำนวนเต็มคูณด้วย 1.602 x 10-19 คูลอมบ์ (coulomb) Milikan จึงนับค่าประจุไฟฟ้าของเม็ดน้ำมันที่น้อยสุดว่ามีค่า = 1 x 1.602 x 10-19 คูลอมบ์ว่าเป็นประจุของเม็ดน้ำมันเมื่อมีอิเล็กตรอน 1 ตัว เพราะฉะนั้นประจุของอิเล็กตรอนมีค่า = 1 x 1.602 x 10-19 coulomb
การหาค่ามวลของอิเล็กตรอน
เมื่อทราบค่าประจุไฟฟ้าของอิเล็กตรอนก็สามารถนำมาแทนค่าในสมการของ Thomson
สมการของ Thomson e/m = 1.759 x108 coulomb / g
แทนค่า e จาก Milikan e = 1.602 x 10-19 coulomb
จะได้มวลของ electron m = 9.11 xx10-28 g
- หลอดรังสีแคโทดของ Eugen Goldstein (การค้นพบ Proton)
การที่อะตอมทุกชนิดมี electron เป็นองค์ประกอบแต่อะตอมมีคุณสมบัติเป็นกลางทางไฟฟ้าทำให้นักวิทยาศาสตร์เชื่อว่าจะต้องมีอนุภาคที่มีประจุไฟฟ้าเป็นบวกเป็นองค์ประกอบในปี ค.ศ. 1889 (พ.ศ. /2429) Eugen Goldstrin นักฟิสิกส์ชาวเยอรมันได้ดัดแปลงหลอดรังสี cathode ดังรูป
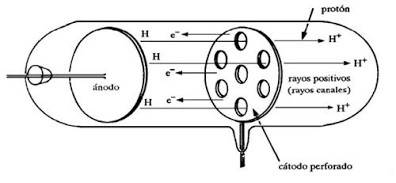 ภาพที่ 2 แสดงหลอดรังสีแคโทดของ Eugen Goldstrin
ภาพที่ 2 แสดงหลอดรังสีแคโทดของ Eugen Goldstrin
ที่มา : https://sites.google.com/site/631laintimidaddelamateria/descubrimiento-de-las-particulas-subatomicas
โดยเลื่อน cathode และ anode ที่เจาะรูมาไว้เกือบตรงกลางและมีฉากเรื่องแสงอยู่ที่ปลายทั้งสองข้างเมื่อผ่านกระแสไฟฟ้าศักดิ์สูงเข้าไปปรากฏว่ามีแสงสว่างเกิดขึ้นบนฉากเรื่องแสงทั้งสองตรงกับตำแหน่งที่เจาะรูไว้แสดงว่ามีรังสีจากขั้ว anode ไปขั้ว cathode ผ่านรูตรงกลางที่เจาะไว้กระทบกับฉากเรืองแสงรังสีนี้จะเกิดขึ้นพร้อมๆกับ cathode ray เรียกรังสีที่พบใหม่ว่า positive ray หรือ anode ray หรือ canal ray
เมื่อทดลองหลายครั้งโดยเปลี่ยนชนิดของ gas ในหลอดพบว่าอนุภาคที่มีประจุบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่คงที่และจะขึ้นกับชนิดของ gas ที่บรรจุในหลอดแต่ถ้าใช้ gas ชนิดเดิมแล้วเปลี่ยนชนิดขั้วโลหะที่ทำ anode พบว่าอัตราส่วนต่อประจุต่อมวลมีค่าคงเดิม
Goldstien ได้สรุปผลการทดลองว่าอัตราส่วนประจุต่อมวลขึ้นอยู่กับชนิดของ gas (gas ต่างชนิดกันจะมีผลมวลต่างกัน)
เมื่อใช้ Hydrogen gas จะได้อนุภาค(H+ (g) มีค่าประจุต่อมวลมากที่สุดโดยที่อนุภาคบวกนี้มีค่าประจุเท่ากับ electron (ทำให้มวลของอนุภาคบวกดังกล่าวมีค่าต่ำสุด) จึงเรียกอนุภาคบวกหรือไอออนบวกจาก Hydogen gas ว่า Proton ซึ่งมาจากภาษากรีกว่า Proteinos ซึ่งมีความหมายเป็นสิ่งสำคัญสิ่งแรก(fist importance)
Thomson เสนอแบบจำลองอะตอมว่า “อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตรอนที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมออะตอมในสภาวะเป็นกลางจะมีประจุบวกเท่ากับประจุลบนอก” จากนี้ยังหาค่า e / m ของ hydrogas หรือ Proton ได้เท่ากับ 9.58 x 104 coulomb/ g แทนค่า e = 1.6 x 10-19 จะได้ค่ามวลของ proton = 1.66 x 10-24 g เมื่อเปรียบเทียบมวลของ proton กับมวลของ electron พบว่ามวลของ proton จะมีค่ามากกว่ามวลของ electron ประมาณ 1800 เท่า
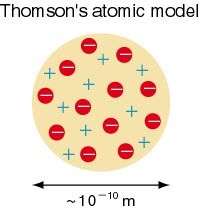 ภาพที่ 3 แสดงแบบจำลองอะตอมของทอมสัน (Thomson)
ภาพที่ 3 แสดงแบบจำลองอะตอมของทอมสัน (Thomson)
ที่มา http://ne.phys.kyushu-u.ac.jp/seminar/MicroWorld1_E/Part2_E/P24_E/Thomson_model_E.htm
-ขอขอบคุณ แหล่งข้อมูลที่สำคัญ https://www.scimath.org/lesson-chemistry/item/7437-2017-08-11-04-28-08
อันนี้เป็นข้อมูลที่ให้บางส่วนเท่านั้น ยังมีความรู้อื่นๆอีกมากมายที่ https://www.scimath.org