ความร้อน สมบัติเชิงกลของแก๊สและทฤษฏีจลน์
ความร้อน สมบัติเชิงกลของแก๊สและทฤษฎีจลน์
4.1 กฏข้อที่ศูนย์ของอุณหพลศาสตร์
กล่าวถึงสภาวะสมดุลทางอุณหพลศาสตร์ โดยสามารถสรุปได้ว่า “ถ้าระบบ A และ B อยู่ในภาวะสมดุลทางอุณหพลศาสตร์ และระบบ B และ C อยู่ในสภาวะสมดุลทางอุณหพลศาสตร์แล้ว ระบบ A และ Cจะอยู่ในภาวะสมดุลทางอุณหพลศาสตร์ด้วยเช่นกัน”
กล่าวโดยสรุปก็คือภาวะสมดุลทางอุณหพลศาสตร์มี คุณสมบัติถ่ายทอด ได้นั่นเอง อนึ่ง ที่มาของชื่อ กฎข้อศูนย์ นี้มีที่มาจากการที่นักวิทยาศาสตร์คิดว่ากฎข้อนี้เป็นรากฐานที่สำคัญต่อกฎข้อที่หนึ่ง จึงต้องการจะให้ตัวเลขชื่อกฎอยู่ต่ำกว่ากฎข้อที่หนึ่ง แต่เนื่องจากกฎข้อนี้เพิ่งจะถูกตระหนักถึงความสำคัญเมื่อหลังจากกฎข้อที่หนึ่งและสองมีชื่อเสียงมานานมากแล้ว นักวิทยาศาสตร์จึงตัดสินใจไม่เปลี่ยนลำดับตัวเลข และตั้งให้กฎข้อนี้เป็นกฎข้อที่ศูนย์
4.2 ก๊าซในอุดมคติ
จากการทดลองและข้อสรุปของนักวิทยาศาสตร์หลายๆ คนที่ศึกษาเรื่องแก๊สเราจะเห็นว่า สมบัติของแก๊สมีความสัมพันธ์กันด้วยตัวแปรคล้ายๆ กัน คือ ทุกคนต่างก็ดูที่ปริมาตรของแก๊สที่เปลี่ยนไป ด้วยการกำหนดตัวแปรต้นแตกต่างกันออกไป
บอยล์ เมื่อเปลี่ยนความดันของแก๊ส ปริมาตรจะเป็นอย่างไร
ชาร์ล เมื่อเปลี่ยนอุณหภูมิของแก๊ส ปริมาตรจะเป็นอย่างไร
อาโวกาโดร เมื่อเปลี่ยนจำนวนโมลหรือจำนวนโมเลกุลของแก๊ส ปริมาตรจะเป็นอย่างไร
และทุกคนก็ได้ข้อสรุปดังที่ได้นำเสนอกฏของทุกคนมาแล้ว ถ้าเรารวบรวมกฎที่เกี่ยวกับแก๊สที่กล่าวมาแล้วทั้งหมด เราจะได้ความสัมพันธ์ดังนี้
จาก
กฏของบอยล์ v แปรผันตรง 1/P
กฎของชาร์ล V แปรผันตรง T
กฏของอาโวกาโดร V แปรผันตรง n
เราสามารถรวมกฎทั้งสามนี้เข้าเป็นสมการรวมเพียงสมการเดียวได้ดังนี้
V แปรผันตรง nT/P
V = Rnt/P
เมื่อ
P = ความดัน
V = ปริมาตร
n = จำนวนโมล
T = อุณหภูมิมีหน่วยเป็นเคลวิน
สมการนี้เรียกว่า สมการแก๊สในอุดมคติ
R = ค่าคงที่ของแก๊ส (gas constant)
จากตัวแปรทั้ง 4 ตัว คือ ความดัน(P), ปริมาตร(V), จำนวนโมล(n) และอุณหภูมิ(T) เราสามารถหาค่า R ได้จากการแทนค่าตัวแปรทั้งสี่ในสมการแก๊สอุดมคติ
แก๊สอุดมคติ 1 โมล ที่สภาวะมาตรฐาน ความดันเท่ากับ 1 บรรยากาศ อุณหภูมิ 273 K มีปริมาตร 22.4 ลิตร เราจะสามารถคำนวณหาค่าคงที่ของแก๊สได้ดังนี้
แก๊สใดๆ ก็ตามที่มีพฤติกรรมเป็นไปตามกฏนี้ จะเรียกแก๊สนั้นว่าแก๊สที่มีพฤติกรรมในอุดมคติ หรือแก๊สอุดมคติ หรือแก๊สสมบูรณ์แบบ (ideal gas)
4.3 ทฤษฏีจลน์ของก๊าซ
ทฤษฎีจลน์ของแก๊สเป็นทฤษฎีที่ใช้อธิบายสมบัติทางฟิสิกส์ของแก๊ส นักวิทยาศาสตร์ที่ได้เสนอทฤษฎีนี้คือ Deniel Bernoulli และทฤษฎีนี้ได้ถูกปรับปรุงโดยนักวิทยาศาสตร์คนอื่น ๆ เพื่อให้มีความสมบูรณ์และถูกต้องยิ่งขึ้น จนได้ทฤษฎีจลน์ของแก๊สในปัจจุบัน ซึ่งมีข้อความดังนี้
1. แก๊สต่างๆประกอบด้วยอนุภาคที่มีขนาดเล็กมากเรียกว่า โมเลกุล
2. โมเลกุลของแก๊สอยู่ห่างกันไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน แต่ละโมเลกุลมีอิสระในการเคลื่อนที่
3. โมเลกุลของแก๊สมีมวลแต่มีขนาดเล็กมากจนถือได้ว่ามีปริมาตรเป็นศูนย์
4. โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอย่างไม่เป็นระเบียบตลอดเวลาด้วย อัตราเร็วคงที่(แต่ไม่จำเป็นต้องเท่ากัน)จนปะทะโมเลกุลอื่นหรือผนังภาชนะจึงจะเปลี่ยนทิศทางอาจเปลี่ยนอัตราเร็วด้วย
5. การชนกันของโมเลกุลเป็นแบบยึดหยุ่นสมบูรณ์คือ เมื่อชนกันแล้วจะไม่มีการสูญเสียพลังงานรวม แต่อาจจะมีการถ่ายเทพลังงานระหว่างโมเลกุลได้
6. ที่อุณหภูมิคงที่ อัตราเร็วเฉลี่ยของแก๊สชนิดหนึ่ง ๆ จะมีค่าคงที่
7. โมเลกุลของแก๊สใด ๆ จะมีพลังงานจลน์เฉลี่ยค่าหนึ่งค่าหนึ่งซึ่งเท่ากับ ? mv2 (เมื่อ m คือมวลโมเลกุลของแก๊ส และv คือความเร็วในการเคลื่อนที่ของโมเลกุลของแก๊ส)
8. ที่อุณหภูมิเดียวกัน แก๊สทุกชนิดจะมีค่าพลังงานจลน์เฉลี่ยเท่ากัน และพลังงานจลน์เฉลี่ย ของแก๊สแปรผันตรงกับอุณหภูมิเคลวิน
หมายเหตุ โมเลกุลของแก๊สที่มีสมบัติเป็นไปตามทฤษฎีจลน์ของแก๊สครบทุกข้อ คือแก๊สในอุดมคติหรือแก๊สสมบัติ ส่วนแก๊สจริงจะมีพฤติกรรมใกล้เคียงแก๊สในอุดมคติ ก็ต่อเมื่ออยู่ในภาวะอุณหภูมิสูงและความดันต่ำ ตัวอย่างเช่น ทฤษฎีของแก๊สข้อ 2) ที่ว่าโมเลกุลไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน สำหรับแก๊สจริงย่อมมีแรงยึดเหนี่ยวอย่างแน่นอน แต่แรงยึดเหนี่ยวนั้นจะมีค่ามากหรือน้อยขึ้นอยู่กับชนิดของแก๊ส แต่อย่างไรก็ตามที่อุณหภูมิสูงโมเลกุลของแก๊สจะมีพลังงานจลน์สูงขึ้น ประกอบกับความดันต่ำด้วย โมเลกุลจึงเคลื่อนที่ออกจากวันมากขึ้นทำให้ระยะห่างระหว่างโมเลกุลมากขึ้น แรงยึดเหนี่ยวระหว่างโมเลกุลจึงลดน้อยลงหรืออาจน้อยมากจนไม่มีเลย แสดงว่าโมเลกุลของแก๊สดังกล่าวกำลังมีพฤติกรรมคล้ายกับแก๊สสมมติ
คำอธิบายเพิ่มเติมทฤษฎีจลน์ของแก๊ส
1. จากทฤษฎีของแก๊สข้อ 5) เมื่อโมเลกุลชนกันเอง อาจมีการถ่ายเทพลังงานแต่ไม่มีการสูญเสียพลังงานรวมนั้น หมายความว่า พลังงานรวมทั้งหมดของระบบไม่เปลี่ยน หรือพลังงานรวมของโมเลกุลของแก๊สทั้งสองโมเลกุลที่ชนกันไม่เปลี่ยน แต่เมื่อโมเลกุลสองโมเลกุลชนกันถ้ามีการถ่ายเทพลังงาน โมเลกุลหนึ่งสูญเสียพลังงานไปเท่าใด อีกโมเลกุลหนึ่งก็จะรับพลังงานเพิ่มขึ้นเท่านั้น
2. จากทฤษฎีจลน์ของแก๊สข้อ 7) และ 8) พลังงานจลน์เฉลี่ยของโมเลกุลของแก๊ส (E) ซึ่งมีค่าเท่ากับ ? mv2 นั้น เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน หมายความว่าเมื่ออุณหภูมิ เพิ่มขึ้นแก๊สก็จะมีพลังงานจลน์เฉลี่ยเพิ่มขึ้น แต่ถ้าอุณหภูมิลดลงแก๊สก็จะมีพลังงานจลน์เฉลี่ยลดลงด้วย (E ? T) และเหตุที่พลังจลน์เฉลี่ยของโมเลกุลของแก๊สเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน เพราะว่าความเร็วเฉลี่ยของโมเลกุลของแก๊ส (v) เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน (อุณหภูมิสูงแก๊สจะมีความเร็วเฉลี่ยสูง อุณหภูมิต่ำแก๊สจะมีความเร็วเฉลี่ยต่ำ)
E = ? mv2
จากสูตร ค่าพลังงานจลน์ เฉลี่ยของโมเลกุลของแก๊ส (E) เป็นสัดส่วนโดยตรงกับความเร็วเฉลี่ย (v) กล่าวคือ ถ้า V มีค่ามาก E ก็จะมีค่ามากด้วย แต่ถ้า v มีค่าน้อย E ก็จะมีค่าน้อยด้วย เนื่องจากค่า v เป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน ดังนั้น ค่า E จึงเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวินด้วย
การใช้ทฤษฎีจลน์อธิบายสมบัติของแก๊ส
ทฤษฎีจลน์ของแก๊สสามารถใช้อธิบายสมบัติของแก๊สในเรื่องที่เกี่ยวข้องกับอุณหภูมิ ความดัน ปริมาตร และจำนวนโมเลกุล (หรือ โมล) ของแก๊สได้
1. ใช้อธิบายว่าทำไมแก๊สจึงมีรูปร่างและปริมาตรไม่แน่นอนขึ้นอยู่กับภาชนะที่บรรจุ
ตามทฤษฎีจลน์ของแก๊สทราบว่าโมเลกุลของแก๊สมีขนาดเล็กมากและไม่มีแรงยึดเหนี่ยวระหว่างกันและกัน ดังนั้นไม่ว่าจะบรรจุแก๊สไว้ในภาชนะชนิดใดก็ตาม โมเลกุลของแก๊สก็จะเคลื่อนที่แพร่กระจายเต็มพื้นที่ภาชนะที่บรรจุ จึงทำให้แก๊สนั้นมีรูปร่างเหมือนภาชนะที่บรรจุ และแก๊สนั้นจะมีปริมาตรเท่าภาชนะที่บรรจุด้วย เช่น เมื่อบรรจุแก๊สX จำนวนหนึ่งในถังสี่เหลี่ยม ซึ่งมีปริมาตร 20 dm3 แก๊สX ก็จะมีรูปร่างเป็นรูปสี่เหลี่ยม และมีปริมาตรเท่ากับ 20 dm3 ด้วย
2.ใช้อธิบายว่าทำไมแก๊สจึงมีความดัน
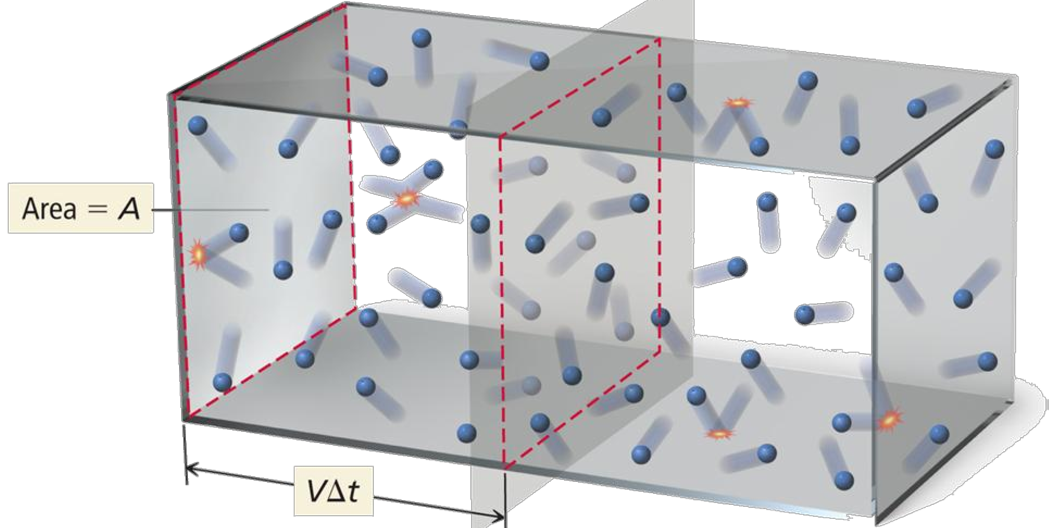
ตามทฤษฎีจลน์ของแก๊สกล่าวว่า โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลา ด้วยอัตราเร็วคงที่ เกิดการชนกันเอง และชนผนังภาชนะอยู่ตลอดเวลา การที่โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะตลอดเวลา ทำให้เกิดแรงดัน และผลรวมของแรงดันทั้งหมดที่มีต่อหนึ่งหน่วยพื้นที่เรียกว่า ความดันของแก๊ส
3. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผกผันกับความดัน เมื่ออุณหภูมิและจำนวนโมลคงที่ ( กฎของบอยล์ )
ปัญหาข้อนี้จะใช้ทฤษฎีจลน์ของแก๊สที่กล่าวว่า ที่อุณหภูมิคงที่ อัตราเร็วเฉลี่ยของแก๊สชนิดเดียวกันจะมีค่าคงที่ และที่อุณหภูมิคงที่แก๊สทุกชนิดมีพลังงานจลน์เฉลี่ยเท่ากันมาอธิบาย ดังนั้นจากความสัมพันธ์ที่ว่า เมื่ออุณหภูมิคงที่ปริมาตรของแก๊สแปรผกผันกับความดัน คือ เมื่อปริมาตรของแก๊สลดลง ความดันของแก๊สจะเพิ่มขึ้น และเมื่อปริมาตรของแก๊สเพิ่มขึ้น ความดันของแก๊สก็จะลดลง ใช้ทฤษฎีจลน์อธิบายได้ดังนี้ การลดปริมาตรแล้วทำให้ความดันเพิ่มขึ้น เพราะการลดปริมาตรโดยอุณหภูมิคงที่ ถึงแม้ว่าโมเลกุลของแก๊สจะมีความเร็วเฉลี่ยและพลังงานจลน์เฉลี่ยคงที่แต่โมเลกุลของแก๊สคงที่ แต่โมเลกุลของแก๊สจะชนผนังภาชนะบ่อยครั้งขึ้นจึงเกิดแรงดันมากขึ้น ทำให้ความดันของแก๊สเพิ่มขึ้น ในทางตรงกันข้ามถ้าเพิ่มปริมาตรทำให้ความดันลดลง เพราะการเพิ่มปริมาตรทำให้โมเลกุลของแก๊สชนผนังภาชนะด้วยความถี่ลดลง แรงดันของแก๊สจึงลดลงด้วย
4. ใช้อธิบายว่าทำไมความดันของแก๊สจึงแปรผันตรงกับจำนวนโมล หรือจำนวนโมเลกุลของแก๊ส เมื่ออุณหภูมิและปริมาตรคงที่
สำหรับปัญหาข้อนี้อธิบายโดยใช้ทฤษฎีจลน์ได้ดังนี้ เนื่องจากโมเลกุลของแก๊สแต่ละโมเลกุลมีการเคลื่อนที่เป็นเส้นตรงอยู่ตลอดเวลาในอัตราเร็วเฉลี่ยคงที่เมื่ออุณหภูมิคงที่ ดังนั้นเมื่อเพิ่มจำนวนโมเลกุล จะทำให้โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะบ่อยครั้งขึ้น เป็นเหตุให้เกิดแรงดันมากขึ้น นั่นคือความดันของแก๊สเพิ่มขึ้น ในทางตรงกันข้ามถ้าลดจำนวนโมเลกุลของแก๊ส จะทำให้โมเลกุลของแก๊สเคลื่อนที่ชนผนังภาชนะด้วยความถี่ลดลง ทำให้แรงดันลดลง นั่นคือความดันของแก๊สลดลง
5. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผันตรงกับโมลหรือจำนวนโมเลกุลของแก๊สเมื่ออุณหภูมิและความดันคงที่ (กฎของอาโวกาโดร)
สำหรับปัญหาข้อนี้อธิบายได้ดังนี้ เมื่อแก๊สมีจำนวนโมเลกุลมากขึ้น โมเลกุลของแก๊สจะชนผนังภาชนะที่บรรจุด้วยความถี่สูงขึ้น ทำให้เกิดแรงดันมากขึ้น นั่นคือแก๊สมีความดันสูงขึ้น และมีค่ามากกว่าความดันภายนอก ถ้าบรรจุแก๊สในกระบอกสูบที่ลูกสูบเคลื่อนที่ได้โดยไม่มีแรงเสียดทานหรือมีน้อย เมื่อแก๊สมีความดันมากขึ้น ก็จะดันให้ลูกสูบเคลื่อนที่ขึ้น ทำให้ปริมาตรของแก๊สเพิ่มขึ้น ทั้งนี้เพื่อให้ความดันมีค่าคงที่นั่นเอง ในทางตรงกันข้าม ถ้าแก๊สมีจำนวนโมเลกุลน้อย ก็จะชนผนังภาชนะที่บรรจุในอัตราความถี่ต่ำลงทำให้เกิดแรงดันน้อย นั่นคือแก๊สมีความดันต่ำลง และต่ำกว่าความดันภายนอกเพื่อรักษาความดันให้คงที่ ลูกสูบก็จะเคลื่อนที่ลง ทำให้ปริมาตรลดลง
6. ใช้อธิบายว่าทำไมปริมาตรของแก๊สจึงแปรผันกับอุณหภูมิเมื่อความดันและจำนวนโมเลกุลของแก๊สคงที่ (กฎของชาร์ล)
จากทฤษฎี พลังงานจลน์เฉลี่ยของแก๊สเป็นสัดส่วนโดยตรงกับอุณหภูมิเคลวิน นั่นคือเมื่ออุณหภูมิสูงแก๊สจะมีพลังงานจลน์เฉลี่ยสูง เมื่ออุณหภูมิต่ำแก๊สจะมีพลังงานจลน์เฉลี่ยต่ำ ดังนั้นถ้าบรรจุแก๊สในกระบอกสูบที่ลูกสูบเคลื่อนที่ขึ้นลงได้สะดวก เมื่ออุณหภูมิ เพิ่มขึ้นโมเลกุลของแก๊สจะมีพลังงานจลน์เฉลี่ยเพิ่มขึ้น จึงเคลื่อนที่ชนผนังภาชนะที่บรรจุได้แรงและบ่อยครั้งขึ้นทำให้แก๊สภายในกระบอกสูบมีความดันมากกขึ้น และมากกว่าความดันภายนอก ก็จะดันให้ลูกสูบเคลื่อนที่ขึ้นเพื่อรักษาความดันให้คงที่ แก๊สภายในกระบอกสูบจึงมีปริมาตรเพิ่มขึ้น ในทางตรงกันข้ามถ้าอุณหภูมิลดลง โมเลกุลของแก๊สจะมีพลังงานจลน์เฉลี่ยลดลงจึงเคลื่อนที่ชนผนังภาชนะที่บรรจุเบาลง และชนด้วยความถี่ต่ำลง ทำให้แก๊สภายในกระบอกสูบมีความดันลดลง และต่ำกว่าความดันภายนอก ทำให้ลูกสูบเคลื่อนที่ลงเพื่อรักษาความดันให้คงที่ แก๊สภายในกระบอกสูบจึงมีปริมาตรลดลง