สาร และ สมบัติของสาร
สสาร ( Matter ) หมายถึงสิ่งที่มีมวล ต้องการที่อยู่ และ สามารถสัมผัสได้โดยประสาทสัมผัสทั้ง 5 เช่น ดิน น้ำ อากาศ ฯลฯ ภายใน สสารเป็นเนื้อของสสาร เรียกว่า สาร ( Substance )
สาร ( Substance ) คือ สสารที่ทราบสมบัติ หรือ สสารที่จะศึกษา ดังนั้นจึงเป็นสสารที่เฉพาะเจาะจง ซึ่งจะมีสมบัติของสาร
2 ประเภท คือ
– สมบัติกายภาพ ( Physical Property ) หมายถึง สมบัติที่สังเกตได้จากลักษณะภายนอก และ เกี่ยวกับวิธีการทางฟิสิกส์ เช่น ความหนาแน่น , จุดเดือด , จุดหลอมเหลว
– สมบัติทางเคมี ( Chemistry Property ) หมายถึง สมบัติที่เกิดขึ้นจากการทำปฏิกิริยาเคมี เช่น การติดไฟ , การเป็นสนิม , ความเป็น กรด – เบส ของสาร
การเปลี่ยนแปลงสาร
การเปลี่ยนแปลงสาร แบ่งออกเป็น 2 รูปแบบ คือ
– การเปลี่ยนแปลงทางกายภาพ ( Physical Change ) หมายถึง การเปลี่ยนแปลงของสารที่เกี่ยวกับสมบัติกายภาพ โดยไม่มีผลต่อ องค์ประกอบภายใน และ ไม่เกิดสารใหม่ เช่น การเปลี่ยนสถานะ , การละลายน้ำ
– การเปลี่ยนแปลงทางทางเคมี ( Chemistry Change ) หมายถึง การเปลี่ยนแปลงของสารที่เกี่ยวข้องกับสมบัติทางเคมีซึ่งมีผลต่อองค์ประกอบภายใน และจะมีสมบัติต่างไปจากเดิม นั่นคือ การเกิดสารใหม่ เช่น กรดเกลือ ( HCl ) ทำปฏิกิริยากับลวด แมกนีเซียม ( Mg ) แล้วเกิดสารใหม่ คือ ก๊าซไฮโดรเจน ( H2 )
การจัดจำแนกสาร
จะสามารถจำแนกออกเป็น 4 กรณี ได้แก่
1. การใช้สถานะเป็นเกณฑ์ แบ่งออกเป็น 3 กลุ่ม คือ
– สถานะที่เป็นของแข็ง ( Solid ) จะมีรูปร่าง และ ปริมาตรคงที่ ซึ่งอนุภาคภายในจะอยู่ชิดติดกัน เช่น ด่างทับทิม ( KMnO4 ) , ทองแดง ( Cu )
– สถานะที่เป็นของเหลว ( Liquid ) จะมีรูปร่างตามภาชนะที่บรรจุ และ มีปริมาตรที่คงที่ ซึ่งอนุภาคภายในจะอยู่ชิดกันน้อยกว่าของแข็ง และ มีสมบัติเป็นของไหล เช่น น้ำมัน , แอลกอฮอล์ , ปรอท ( Hg ) ฯลฯ
– สถานะที่เป็นก๊าซ ( Gas ) จะมีรูปร่าง และ ปริมาตรที่ไม่คงที่ โดยรูปร่าง จะเปลี่ยนไปตามภาชนะที่บรรจุ อนุภาคภายในจะอยู่ ห่างกันมากที่สุด และ มีสมบัติเป็นของไหลได้ เช่น ก๊าซหุงต้ม , อากาศ
2. การใช้เนื้อสารเป็นเกณฑ์ จะมีสมบัติทางกายภาพของสารที่ได้จากการสังเกตลักษณะความแตกต่างของเนื้อสาร ซึ่งจะจำแนกได้ออกเป็น 2 กลุ่ม คือ
– สารเนื้อเดียว ( Homogeneous Substance ) หมายถึง สารที่มีเนื้อสารเหมือนกันทุกส่วน ทำให้สารมีสมบัติเหมือนกันตลอดทุกส่วน เช่น แอลกอฮอล์ , ทองคำ ( Au ) , โลหะบัดกรี
– สารเนื้อผสม ( Heterogeneous Substance ) หมายถึง สารที่มีเนื้อสารแตกต่างกันในแต่ละส่วน จะทำให้สารนั้นมีสมบัติ ไม่เหมือนกันตลอดทุกส่วน เช่น น้ำอบไทย , น้ำคลอง ฯลฯ
3. การละลายน้ำเป็นเกณฑ์ จะจำแนกได้ออกเป็น 3 กลุ่ม คือ
– สารที่ละลายน้ำได้ เช่น เกลือแกง ( NaCl ) , ด่างทับทิม ( KMnO4 ) ฯลฯ
– สารที่ละลายน้ำได้บ้าง เช่น ก๊าซคลอรีน ( Cl2 ) , ก๊าซคาร์บอนไดออกไซด์ ( CO2 ) ฯลฯ
– สารที่ไม่สามารถละลายน้ำได้ เช่น กำมะถัน ( S8 ) , เหล็ก ( Fe ) ฯลฯ
4. การนำไฟฟ้าเป็นเกณฑ์ จะจำแนกได้ออกเป็น 2 กลุ่ม ได้แก่
– สารที่นำไฟฟ้าได้ เช่น ทองแดง ( Cu ) , น้ำเกลือ ฯลฯ
– สารที่ไม่นำไฟฟ้า เช่น หินปูน ( CaCO3 ) , ก๊าซออกซิเจน ( O2 )
แต่โดยส่วนใหญ่นักเคมี จะแบ่งสารตามลักษณะเนื้อสารเป็นเกณฑ์ ดังนี้
สารบริสุทธิ์ ( Pure Substance ) คือ สารเนื้อเดียวที่มีจุดเดือด และ จุดหลอมเหลวคงที่
ธาตุ ( Element ) คือ สารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียวกัน เช่น คาร์บอน ( C ) , กำมะถัน ( S8 )
สารประกอบ ( Compound Substance ) เกิดจากธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกัน โดยมีอัตราส่วนในการร่วมกันคงที่แน่นอนได้แก่ กรดน้ำส้ม ( CH3COOH ) , กรดไฮโดรคลอริก ( HCl ) ฯลฯ
ของผสม ( Mixture ) หมายถึง สารที่เกิดจากการนำสารตั้งแต่ 2 ชนิดขึ้นไปมาผสมกันโดยไม่จำกัดส่วนผสม และ ในการผสมกัน
นั้นไม่มีปฏิกิริยาเกิดขึ้นระหว่างสารองค์ประกอบที่นำมาผสมกัน ซึ่งมี 3 ประเภท ได้แก่
1. สารละลาย ( Solution Substance ) เป็นสารเนื้อเดียวที่มีสัดส่วนในการรวมกันของธาตุ หรือ สารประกอบไม่คงที่ไม่สามารถเขียนสูตรได้อย่างแน่นอน และ มีขนาดอนุภาคที่เล็กกว่า 10-7 เซนติเมตร ซึ่งมี 3 สถานะ เช่น อากาศ , น้ำอัดลม , นาก , และ โลหะผสม ทุกชนิด ฯลฯ ซึ่งสารละลายจะแบ่งออกเป็น 2 ส่วน ได้แก่ ตัวทำละลาย ( Solvent ) และ ตัวถูกละลาย ( Solute ) จะมีข้อสังเกต ดังนี้
– สารใดที่มีปริมาณมากจะเป็นตัวทำละลาย และ สารใดมีปริมาณน้อยจะเป็นตัวถูกละลาย เช่น
แอลกอฮอล์ฆ่าเชื้อ มีเอทานอล 70 % และ น้ำ ( H2O ) 30 % หมายความว่า น้ำจะเป็นตัวถูกละลาย และ เอทานอลเป็นสารละลาย เพราะแอลกอฮอล์มีปริมาณตามเปอร์เซนต์ที่มากกว่าน้ำ
– สารใดที่มีสถานะเช่นเดียวกับสารละลายเป็นตัวทำละลาย เช่น
น้ำเชื่อม ซึ่งน้ำเชื่อมจัดอยู่ในสภาพที่เป็นของเหลว ( Liquid ) ดังนั้นจึงสรุปได้ว่า น้ำเป็นตัวทำละลาย และ น้ำตาลทราย ( C12H22O11 ) เป็นตัวถูกละลาย
2. สารแขวนลอย ( Suspension Substance ) คือ สารที่เกิดจากอนุภาคขนาดเส้นผ่าศูนย์กลางที่มากกว่า 10-4 เซนติเมตร ซึ่งจะลอยกระจายอยู่ในตัวกลางโดยอนุภาคที่มีอยู่ในของผสมนั้นมีขนาดใหญ่ จึงสามารถมองเห็นอนุภาคในของผสมได้อย่างชัดเจน เมื่อตั้งทิ้งไว้ อนุภาคจะตกตะกอนลงมา ซึ่งสารแขวนลอยนั้นจะไม่สามารถผ่านได้ทั้งกระดาษกรอง และ กระดาษเซลโลเฟน เช่น โคลน , น้ำอบไทย
3. คอลลอยด์ ( Colliod ) จะประกอบด้วยอนุภาคขนาดเส้นผ่าศูนย์กลางระหว่าง 10-4 และ 10-7 เซนติเมตร ซึ่งจะไม่มีการตกตะกอน สามารถกระเจิงแสงได้ ซึ่งเรียกปรากฏการณ์นี้ว่า ” ปรากฏการณ์ทินดอลล์ ” และ ภายในอนุภาคก็มีการเคลื่อนที่แบบบราวน์เนียน( Brownian Movement ) กล่าวคือ เป็นการเคลื่อนที่ที่ไม่แน่นอน ในแนวเส้นตรง ซึ่งจะสามารถส่องดูได้จากเครื่องที่เรียกว่า ” อัลตราไมโครสโคป ” ( Ultramicroscope ) ซึ่งคอลลอยด์จะสามารถผ่านกระดาษกรองได้ แต่ไม่สามารถผ่านกระดาษเซลโลเฟนได้ เช่น กาว , นมสด
คอลลอยด์ในชีวิตประจำวัน
คอลลอยด์มีหลายชนิด ดังนี้
|
ประเภทของคอลลอยด์ |
สถานะของอนุภาค |
สถานะของตัวกลาง |
ตัวอย่าง |
|
แอโรซอล |
ของเหลว |
ก๊าซ |
เมฆ , สเปรย์ , หมอก |
|
แอโรซอล |
ของแข็ง |
ก๊าซ |
ควันไฟ , ฝุ่น |
|
อิมัลชัน |
ของเหลว |
ของเหลว |
นมสด , น้ำกะทิ , สลัด |
|
เจล |
ของแข็ง |
ของเหลว |
เยลลี่ , วุ้น , กาว , ยาสีฟัน |
|
โฟม |
ก๊าซ |
ของเหลว |
ฟองสบู่ , ครีมโกนหนวด |
|
โฟม |
ก๊าซ |
ของแข็ง |
เม็ดโฟม , สบู่ก้อน |
คอลลอยด์ที่พบในชีวิตประจำวัน คือ อิมัลชัน ( Emulsion ) โดยอิมัลชัน คือ คอลลอยด์ที่เกิดระหว่างของเหลว กับของเหลว ซึ่ง สามารถปนเป็นเนื้อเดียวกันได้โดยมีอิมัลซิฟายเออร์ ( Emulsifier ) เป็นตัวประสาน เช่น น้ำ + น้ำมัน ( ไม่สามารถรวมตัวกันได้ ) ดังนั้น น้ำสบู่จึงเป็นอิมัลซิฟายเออร์เป็นตัวประสานจึงสามารถรวมตัวกันได้
การทดสอบความบริสุทธิ์ของสาร
มี 3 ประเภท ได้แก่
1. การหาจุดเดือด ( Boiling Point ) การที่สารไม่บริสุทธิ์ หรือ สารละลายจุดเดือดไม่คงที่ เกิดจากอัตราส่วนระหว่างจำนวนโมเลกุลของตัวถูกละลาย และ ตัวทำละลาย เปลี่ยนแปลงไปโมเลกุลที่มีจุดเดือดต่ำจะระเหยไปเร็วกว่าทำให้สารที่มีจุดเดือดสูงใน อัตราส่วนที่ มากกว่าจึงเป็นผลให้จุดเดือดสูงขึ้นเรื่อย ๆ โดยดูจากรูปที่แสดงเป็นกราฟ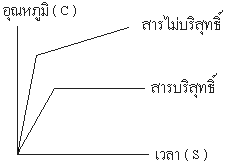
2. การหาจุดหลอมเหลว ( Melting Point ) จะสามารถทดสอบกับสารที่บริสุทธิ์ และสารที่ไม่บริสุทธิ์ได้ โดย
– สารบริสุทธิ์จะมีจุดหลอมเหลวคงที่ และ มีอุณหภูมิช่วงการหลอมเหลวแคบ
– สารไม่บริสุทธิ์จะมีจุดหลอมเหลวไม่คงที่ และ มีอุณหภูมิในช่วงการหลอมเหลวกว้างซึ่งอุณหภูมิฃ่วงการหลอม หมายถึง อุณหภูมิที่สารเริ่มต้นหลอมจนกระทั่งสารนั้นหลอมหมดโดยในอุณหภูมิช่วงการหลอม ถ้าแคบต้องไม่เกิน 2 องศาเซลเซียส โดยดูจากรูปที่แสดงเป็นกราฟ
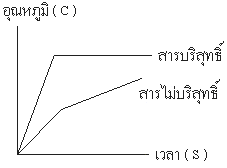
3. การหาจุดเยือกแข็ง ( Freezing Point ) จะสามารถทดสอบกับสารบริสุทธิ์ และ สารไม่บริสุทธิ์ ซึ่งไม่ค่อยนิยม เพราะจะต้อง ใช้เวลานานมากในการหาจุดเยือกแข็ง โดย
– สารบริสุทธิ์จะมีจุดเยือกแข็งคงที่
– สารไม่บริสุทธิ์จะมีจุดเยือกแข็งไม่คงที่
โดยดูจากรูปที่แสดงเป็นกราฟ

-ขอบคุณแหล่งข้อมูล http://nakhamwit.ac.th






