– สมบัติของสาร หมายถึง ลักษณะเฉพาะตัวของสาร เช่น เนื้อสาร สี กลิ่น รส การนำไฟฟ้า การละลายน้ำ จุดเดือด จุดหลอมเหลว ความเป็นกรด–เบส เป็นต้น แบ่งสมบัติของสารออกเป็น 2 ประเภท คือ
1) สมบัติทางกายภาพ หรือสมบัติทางฟิสิกส์ ( physical properties ) หมายถึง สมบัติของสารที่สามารถสังเกตได้จากลักษณะภายนอก หรือจากการทดลองที่ไม่เกี่ยวข้องกับปฏิกิริยาเคมี เข่น สถานะ เนื้อสาร สี กลิ่น รส ความหนาแน่น จุดเดือด จุดหลอมเหลว การนำไฟฟ้า การละลายน้ำ ความแข็ง ความเหนียว เป็นต้น
2) สมบัติทางเคมี ( chemical properties ) หมายถึง สมบัติที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมีและองค์ประกอบทางเคมีของสาร เช่น การติดไฟ การผุกร่อน การทำปฏิกิริยากับน้ำ การทำปฏิกิริยากับกรด – เบส เป็นต้น
– การเปลี่ยนแปลงของสสาร สามารถแบ่งการเปลี่ยนแปลงออกได้เป็นสอง ประเภท คือ การเปลี่ยนแปลงทางกายภาพ (Physical Change) และการเปลี่ยนแปลงทางเคมี (Chemical Change)
1) การเปลี่ยนแปลงทางกายภาพ เป็นการเปลี่ยนแปลงที่สามารถสังเกตได้โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของสสาร แต่เกิดการจัดเรียงตัวของอนุภาคใหม่เท่านั้น ดังรูปที่ 1 การเปลี่ยนสถานะของน้ำ โดยเมื่อน้ำแข็งได้รับความร้อนจะหลอมเหลวกลายเป็นน้ำในรูปของเหลว และเมื่อได้รับความร้อนต่อไปอีกสามารถเปลี่ยนเป็นไอน้ำได้ โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของน้ำแต่อย่างใด
2) การเปลี่ยนแปลงทางเคมี เป็นการเปลี่ยนแปลงองค์ประกอบภายในของสสาร เกิดเป็นสารใหม่ขึ้นมา ทั้งนี้เพราะมีปฏิกิริยาเคมีเกิดขึ้นนั่นเอง การเปลี่ยนแปลงทางเคมี ได้แก่ การเผาไหม้ การย่อยอาหาร การเกิดสนิม การรวมตัวของโมเลกุลของสารต่างๆ เป็นต้น การเปลี่ยนแปลงทางเคมี ทำให้ได้สารใหม่เกิดขึ้นเสมอ ซึ่งสามารถเขียนเป็นสมการเคมีขึ้นแทนปฏิกิริยาเคมีที่เกิดขึ้นได้ ตัวอย่างของการเปลี่ยนแปลงทางเคมี เช่น การเกิดนมเปรี้ยว การปิ้งขนมปัง การเกิดสนิมของตะปู การจุดประกายของน้ำมันในเครื่องยนต์ การเกิดฟองของไฮโดรเจนเปอร์ออกไซด์ (H2O2) ในบาดแผล การจุดไม้ขีดไฟ การกินยาลดกรด เป็นต้น
– สถานะของสาร สารแบ่งออกเป็น 3 สถานะ คือ
1) ของแข็ง ( solid ) หมายถึง สารที่มีลักษณะรูปร่างไม่เปลี่ยนแปลง และมีรูปร่างเฉพาะตัว เนื่องจากอนุภาคในของแข็งจัดเรียงชิดติดกันและอัดแน่นอย่างมีระเบียบไม่มีการเคลื่อนที่หรือเคลื่อนที่ได้น้อยมาก ไม่สามารถทะลุผ่านได้และไม่สามารถบีบหรือทำให้เล็กลงได้ เช่น ไม้ หิน เหล็ก ทองคำ ดิน ทราย พลาสติก กระดาษ เป็นต้น
2) ของเหลว ( liquid ) หมายถึง สารที่มีลักษณะไหลได้ มีรูปร่างตามภาชนะที่บรรจุ เนื่องจากอนุภาคในของเหลวอยู่ห่างกันมากกว่าของแข็ง อนุภาคไม่ยึดติดกันจึงสามารถเคลื่อนที่ได้ในระยะใกล้ และมีแรงดึงดูดซึ่งกันและกัน มีปริมาตรคงที่ สามารถทะลุผ่านได้ เช่น น้ำ แอลกอฮอล์ น้ำมันพืช น้ำมันเบนซิน เป็นต้น
3) แก๊ส ( gas ) หมายถึง สารที่ลักษณะฟุ้งกระจายเต็มภาชนะที่บรรจุ เนื่องจากอนุภาคของแก๊สอยู่ห่างกันมาก มีพลังงานในการเคลื่อนที่อย่างรวดเร็วไปได้ในทุกทิศทางตลอดเวลา จึงมีแรงดึงดูดระหว่างอนุภาคน้อยมาก สามารถทะลุผ่านได้ง่าย และบีบอัดให้เล็กลงได้ง่าย เช่น อากาศ แก๊สออกซิเจน แก๊สหุงต้ม เป็นต้น
ในปี พ.ศ. 2348 ( ค.ศ. 1805 ) จอห์น ดาลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอแนวคิดว่า “ อนุภาคที่เล็กที่สุดของสารซึ่งไม่สามารถแบ่งย่อยให้เล็กลงได้อีก เรียกว่า อะตอม “ และต่อมานักวิทยาศาสตร์ได้ศึกษาค้นคว้าเกี่ยวกับอะตอมและอนุภาคของสารมากขึ้นทำให้ทราบว่าอนุภาคของสารที่สำคัญมี 3 ชนิด คือ
1. อะตอม ( atom ) เป็นอนุภาคของสารที่เล็กที่สุดที่อยู่ตามลำพังได้ยาก ดังนั้นอะตอมมักจะอยู่รวมกันเป็นอนุภาคที่ใหญ่ขึ้น เรียกว่า “ โมเลกุล “ เช่น อะตอมของออกซิเจน ( O ) จะรวมกันเป็นโมเลกุลของแก๊สออกซิเจน ( O2 ) , อะตอมของไฮโดรเจน( H ) รวมกับอะตอมของออกซิเจน ( O ) เป็นโมเลกุลของน้ำ ( H O2 ) เป็นต้น หรืออะตอมอาจรวมกันเป็นโครงสร้างขนาดใหญ่เรียกว่า “ โครงผลึกหรือผลึก “ เช่น คาร์บอน ( C ) จะอยู่รวมกันในธรรมชาติเป็นโครงผลึกขนาดใหญ่และมีความแข็งแรงมากในรูปของเพชรหรือแกรไฟต์
การศึกษาเกี่ยวกับอะตอมของธาตุนิยมใช้สัญลักษณ์แทนการเรียนชื่อธาตุโดยใช้อักษรตัวแรกและตัวอักษรถัดไปในภาษาอังกฤษหรือภาษาละติน แต่การอ่านชื่อธาตุอ่านเป็นภาษาอังกฤษเสมอ เช่น ธาตุไฮโดรเจน ชื่อภาษาอังกฤษ hydrogen สัญลักษณ์ H เป็นต้น
2. โมเลกุล ( molecule ) หมายถึงอนุภาคที่เล็กที่สุดของสารที่สามารถอยู่ในธรรมชาติได้อย่างอิสระ โมเลกุลเกิดจากอะตอมตั้งแต่ 2 อะตอมขึ้นไปมารวมกันในทางเคมี และเขียนแทนโมเลกุลด้วยสัญลักษณ์ของอะตอมที่มารวมกันนี้ว่า สูตรเคมี เช่น โมเลกุลของน้ำ สูตรโมเลกุล คือ H O2
3. ไอออน ( ion ) หมายถึงอะตอมหรือกลุ่มของอะตอมที่มีประจุไฟฟ้า มี 2 ชนิด คือ ไอออนบวก และไอออนลบ เช่น H – (ไฮโดรเจนไอออน ) , Na+ ( โซเดียมไอออน ) เป็นต้น
ประเภทของสารและการจำแนกประเภท
การจำแนกประเภทของสาร
ในการศึกษาเรื่องสาร จำเป็นต้องแบ่งสารออกเป็นหมวดหมู่ เพื่อให้ง่ายต่อการจดจำสาร โดยทั่วไปนิยมใช้สมบัติทางกายภาพด้านใดด้านหนึ่งของสารเป็นเกณฑ์ในการจำแนกสารซึ่งมีหลายเกณฑ์ด้วยกัน เช่น
1.ใช้สถานะเป็นเกณฑ์ จะแบ่งสารออกได้เป็น 3 กลุ่ม คือ
1.1 ของแข็ง ( solid )
1.2 ของเหลว ( liquid )
1.3 ก๊าซ ( gas )ใช้
2.ใช้ความเป็นโลหะเป็นเกณฑ์ แบ่งได้เป็น 3 กลุ่ม คือ
2.1 โลหะ ( metal)
2.2 อโลหะ ( non-metal)
2.3 กึ่งโลหะ ( metaliod )
3.ใช้การละลายน้ำเป็นเกณฑ์ แบ่งได้ 2 กลุ่ม คือ
3.1 สารที่ละลายน้ำ
3.2 สารที่ไม่ละลายน้ำ
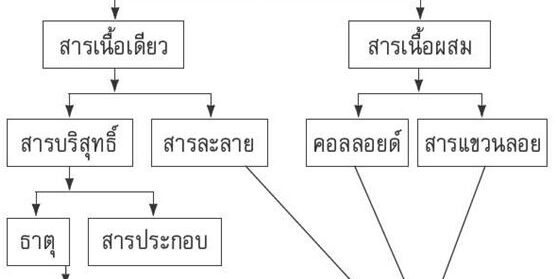
4.ใช้เนื้อสารเป็นเกณฑ์ แบ่งออกเป็น 2 กลุ่ม คือ
4.1 สารเนื้อเดียว ( homogeneous substance )
4.2 สารเนื้อผสม ( heterogeneous substance )
สารเนื้อเดียว
สารเนื้อเดียว ( Homogeneous Substance ) หมายถึง สารที่มีลักษณะของเนื้อสารผสมกลมกลืนกันเป็นเนื้อเดียว และมีอัตราส่วนของผสมเท่ากัน ถ้านำส่วนใดส่วนหนึ่งของสารเนื้อเดียวไปทดสอบจะมีสมบัติเหมือนกันทุกประการ เช่น น้ำกลั่นและเกลือแกง เป็นสารเนื้อเดียว เมื่อนำเกลือแกงใส่ในน้ำแล้วคนให้ละลายจะได้สารละลายน้ำเกลือ ซึ่งเป็นสารเนื้อเดียวที่มีอัตราส่วนของน้ำและเกลือแกงเหมือนกันทุกส่วน
สารเนื้อเดียวมีได้ทั้ง 3 สถานะ คือ
1.สารเนื้อเดียวสถานะของแข็ง เช่น เหล็ก ทองคำ ทองแดง สังกะสี อะลูมิเนียม นาก ฟิวส์ ทองเหลือง หินปูน เกลือแกง น้ำตาลทราย เป็นต้น
2.สารเนื้อเดียวสถานะของเหลว เช่น น้ำกลั่น น้ำเกลือ น้ำส้มสายชู น้ำอัดลม น้ำมันพืช เอทานอล น้ำเชื่อม น้ำนม เป็นต้น
3.สารเนื้อเดียวสถานะแก๊ส เช่น อากาศ แก๊สหุงต้ม แก๊สออกซิเจน แก๊สไนโตรเจน แก๊สคาร์บอนไดออกไซด์ เป็นต้น
นักวิทยาศาสตร์จำแนกสารเนื้อเดียวออกเป็น 2 ประเภท คือ
1.สารบริสุทธิ์ ( Pure Substance ) เป็นสารเนื้อเดียวที่ประกอบด้วยสารเพียงอย่างเดียว ไม่มีสารอื่นเจือปน ได้แก่ ธาตุและสารประกอบ
2.สารไม่บริสุทธิ์ เป็นสารเนื้อเดียวที่ประกอบด้วยสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปด้วยอัตราส่วนที่ไม่แน่นอน ไม่มีปฏิกิริยาเคมีเกิดขึ้น สารที่เกิดใหม่จะมีสมบัติไม่คงที่ขึ้นอยู่กับปริมาณของสารบริสุทธิ์ที่นำมาผสมกัน ได้แก่ สารละลาย คอลลอยด์
ธาตุ ( Element ) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียว ธาตุจึงไม่สามารถแบ่งย่อยลงไปได้อีกเนื่องจากอะตอมทั้งหมดในสารนั้นเป็นชนิดเดียวกัน อะตอมของธาตุบางชนิดอยู่รวมกันเป็นผลึก เช่น ธาตุเหล็ก ( Fe ) ธาตุทองคำ ( Au ) ธาตุสังกะสี ( Zn ) ธาตุเงิน ( Ag ) เป็นต้น ธาตุบางชนิดมีอะตอมอยู่รวมกันเป็นโมเลกุล เช่น ธาตุออกซิเจน ( O2 ) ธาตุไนโตรเจน (N2 ) ธาตุคลอรีน (Cl2 ) ธาตุฟอสฟอรัส (P4 )ธาตุกัมมะถัน (S8 ) เป็นต้น ธาตุบางชนิดอะตอมจะอยู่อย่างอิสระเพียงลำพัง เช่น ธาตุฮีเลียม ( He ) ธาตุนีออน ( Ne ) และธาตุอาร์กอน ( Ar ) ซึ่งจัดเป็นธาตุเฉื่อย
นักวิทยาศาสตร์ใช้สมบัติทางกายภาพจำแนกธาตุออกเป็น 3 กลุ่ม คือ
1.โลหะ ( Metals ) เป็นธาตุที่มีมากที่สุดส่วนใหญ่มีสถานะของแข็งที่อุณหภูมิห้อง ยกเว้นปรอท มีสมบัติทั่วไป คือ นำความร้อนได้ดี มีความเหนียว นำไฟฟ้าได้ดี ผิวเป็นมันวาว สะท้อนแสงได้ ตีเป็นแผ่นบางได้ เช่น เหล็ก ทองคำ เงิน เป็นต้น
2. อโลหะ ( Nonmetals ) เป็นธาตที่มีจำนวนมากรองลงมาจากโลหะมีทั้งสถานะของแข็ง ของเหลวและแก๊ส แต่ส่วนใหญ่จะมรสถานะแก๊สที่อุณหภูมิห้อง มีสมบัติตรงกันข้ามกับโลหะ เช่น ไฮโดรเจน ออกซิเจน ไนโตรเจน คลอรีน เป็นต้น
3. กึ่งโลหะ (Metalloids ) อาจเรียกได้ว่าสารกึ่งตัวนำ ( Semiconductors ) เป็นธาตุที่มีจำนวนน้อยมากมีสมบัติของโลหะและอโลหะอยู่ในธาตุเดียวกัน เช่น พลวง สารหนู ซิลิคอน โบรอน เป็นต้น
สารประกอบ
สารประกอบ ( Compound ) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกันทางเคมีด้วยอัตราส่วนที่คงที่เกิดเป็นสารชนิดใหม่ที่มีสมบัติแตกต่างไปจากเดิมอย่างเด่นชัด เช่น โซเดียม ( Na ) เป็นโลหะสีเงินอ่อน-ขาวทำปฏิกิริยากับน้ำ กับ คลอรีน ( Cl ) เป็นแก๊สพิษสีเหลือง-อมเขียว มีกลิ่นฉุนว่องไวต่อปฏิกิริยา เมื่อนำมารวมกันทางเคมี จะได้โซเดียมคลอไรด์ ( NaCl ) หรือเกลือแกง ซึ่งเป็นของแข็งสีขาว รสเค็ม ละลายน้ำได้ดี รับประทานได้ เป็นต้นโดยทั่วไปสัญญลักษณ์ที่ใช้เขียนแทนชื่อสารประกอบจะอยู่ในรูปของสูตรโมเลกุล
คอลลอยด์
คอลลอยด์ ( Colloid ) เป็นสารเนื้อเดียวที่เกิดจากการรวมตัวกันทางกายภาพของสารตั้งแต่ 2 ชนิดขึ้นไป มีลักษณะมัวหรือขุ่น ไม่ตกตะกอน ขนาดของอนุภาคมีเส้นผ่าศุนย์กลางประมาณ10 – 7 ถึง 10 – 4 เซนติเมตร สามารถลอดผ่านกระดาษกรองได้ แต่ไม่สารลอดผ่านกระดาษเซลโลเฟนได้เมื่อผ่านลำแสงดเข้าไปในคอลลอยด์ จะเกิดการกระเจิงของแสง ทำให้มองเห็นลำแสงได้อย่างชัดเจน เรียกว่าปรากฏการณ์ทินดอลล์ ( Tyndall Effect ) ซึ่งค้นพบโดยนักวิทยาศาสตร์ชาวไอร์แลนด์ ชื่อ จอนห์ ทินดอลล์ เมื่อปี พ.ศ. 2412
ปรากฏการณ์ทินดอลล์ที่พบเห็นในชีวิตประจำวัน ได้แก่ลำแสงที่เกิดจากแสงอาทิตย์ส่องผ่านรูเล็กๆ หรือรอยแตกของฝาผนังบ้านผ่านฝุ่นละอองในอากาศลำแสงที่เกิดจากไฟฉาย ไฟรถยนต์หรือสปอตไลต์ส่องผ่านกลุ่มหมอก ควัน หรือฝุนละอองในอากาศ
อิมัลชั่น ( Emulsion ) หมายถึง คอลลอยด์ที่เกิดจากของเหลว 2 ชนิดที่ไม่รวมเป็นเนื้อเดียวกัน แต่เมื่อเขย่าด้วยแรงที่มากพออนุภาคของของเหลวทั้ง 2 จะแทรกกันอยู่ได้เป็นคอลลอยด์ แต่เมื่อตั้งทิ้งไว้ระยะหนึ่งของเหลวทั้ง 2 จะแยกออกจากกันเหมือนเดิม การที่จะทำให้อิมัลชันอยู่รวมเป็นเนื้อเดียวกันต้องเติมสารที่ทำหน้าที่เป็นตัวประสาน ซึ่งเรียกว่า อิมัลซิฟายเออร์ ( Emulsifler ) เช่นคราบน้ำมันในจานอาหาร เมื่อนำไปล้างจะเกิดอิมัลชัน ซึ่งประกอบด้วยน้ำและน้ำมัน แต่งเมื่อใช้น้ำยาล้างจานเป็นอิมัลซิฟายเออร์ ก็จะสามารถล้างจานได้น้ำสลัด มีสาวนผสมของน้ำมันพืชกับน้ำส้มสายชู มีไข่แดงเป็นอิมัลซิฟายเออร์การย่อยไขมันในลำไส้เล็ก มีไขมันกับเอนไซม์ ( น้ำย่อย ) เป็นอิมัลชัน โดยมีน้ำดีเป็นอิมัลซิฟายเออร์
สารละลาย ( Solution )
หมายถึง สารเนื้อเดียวที่ไม่บริสุทธิ์ เกิดจากการรวมกันทางกายภาพของสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปในอัตราส่วนที่ไม่แน่นอน โดยยังคงสมบัติของสารเดิมไว้สารละลายประกอบด้วย ตัวทำละลาย ( Solvent ) ตัวถูกละลาย ( Solute ) ซึ่งรวมอยู่เป็นเดียวอาจอยู่ในรูปของแข็ง ของเหลวหรือแก๊สก็ได้
สารเนื้อผสม
สารเนื้อผสม ( Heterogeneous Substance ) หมายถึง สารที่มีลักษณะของเนื้อสารคละกัน ไม่ผสมกลมกลืนเป็นเนื้อเดียวกัน สารที่เป็นส่วนผสมแต่ละชนิดก็ยังคงแสดงสมบัติของสารเดิม เพราะเป็นการรวมกันทางกายภาพไม่มีการเปลี่ยนแปลงทางเคมีเกิดขึ้น เราสามารถใช้ตาเปล่าสังเกตและจำแนกได้ว่าสารเนื้อผสมนั้นประกอบด้วยสารใดบ้าง และสามารถแยกสารเหล่านั้นออกจากกันได้โดยวิธีทางกายภาพธรรมดา โดยไม่ทำให้สมบัติเดิมเปลี่ยนแปลงไป
สารเนื้อผสมมีได้ทั้ง 3 สถานะ เช่น
1. สารเนื้อผสมสถานะของแข็ง เช่น ทราย คอนกรีต ดิน เป็นต้น
2. สารเนื้อผสมสถานะของเหลว เช่น น้ำคลอง น้ำโคลน น้ำจิ้มไก่ เป็นต้น
3. สารเนื้อผสมสถานะแก๊ส เช่น ฝุ่นละอองในอากาศ เขม่า ควันดำในอากาศ เป็นต้น
สารแขวนลอย
สารแขวนลอย ( Suspension ) สารแขวนลอยเป็นสารผสมที่อนุภาคของแข็งมีขนาดใหญ่กว่า เซนติเมตร แขวนลอยอยู่ในตัวกลางที่เป็นของเหลว มีลักษณะเป็นสารเนื้อผสมที่อนุภาคไม่รวมเป็นเนื้อเดียวกัน สามารถมองเห็นสารผสมได้อย่างชัดเจน อาจแขวนลอยอยู่ในของเหลวหรือตกตะกอนเมื่อตั้งทิ้งไว้
อนุภาคของสารแขวนลอยไม่สามารถผ่านกระดาษกรองและกระดาษเซลโลเฟนได้ เช่น ผงถ่านในน้ำ น้ำคลอง น้ำโคลน น้ำส้มค้น น้ำจิ้มไก่ แป้งมันในน้ำ เป็นต้น
– สมบัติของสาร หมายถึง ลักษณะเฉพาะตัวของสาร เช่น เนื้อสาร สี กลิ่น รส การนำไฟฟ้า การละลายน้ำ จุดเดือด จุดหลอมเหลว ความเป็นกรด–เบส เป็นต้น แบ่งสมบัติของสารออกเป็น 2 ประเภท คือ
1) สมบัติทางกายภาพ หรือสมบัติทางฟิสิกส์ ( physical properties ) หมายถึง สมบัติของสารที่สามารถสังเกตได้จากลักษณะภายนอก หรือจากการทดลองที่ไม่เกี่ยวข้องกับปฏิกิริยาเคมี เข่น สถานะ เนื้อสาร สี กลิ่น รส ความหนาแน่น จุดเดือด จุดหลอมเหลว การนำไฟฟ้า การละลายน้ำ ความแข็ง ความเหนียว เป็นต้น
2) สมบัติทางเคมี ( chemical properties ) หมายถึง สมบัติที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมีและองค์ประกอบทางเคมีของสาร เช่น การติดไฟ การผุกร่อน การทำปฏิกิริยากับน้ำ การทำปฏิกิริยากับกรด – เบส เป็นต้น
– การเปลี่ยนแปลงของสสาร สามารถแบ่งการเปลี่ยนแปลงออกได้เป็นสอง ประเภท คือ การเปลี่ยนแปลงทางกายภาพ (Physical Change) และการเปลี่ยนแปลงทางเคมี (Chemical Change)
1) การเปลี่ยนแปลงทางกายภาพ เป็นการเปลี่ยนแปลงที่สามารถสังเกตได้โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของสสาร แต่เกิดการจัดเรียงตัวของอนุภาคใหม่เท่านั้น ดังรูปที่ 1 การเปลี่ยนสถานะของน้ำ โดยเมื่อน้ำแข็งได้รับความร้อนจะหลอมเหลวกลายเป็นน้ำในรูปของเหลว และเมื่อได้รับความร้อนต่อไปอีกสามารถเปลี่ยนเป็นไอน้ำได้ โดย ที่ไม่มีการเปลี่ยนแปลงองค์ประกอบภายในของน้ำแต่อย่างใด
2) การเปลี่ยนแปลงทางเคมี เป็นการเปลี่ยนแปลงองค์ประกอบภายในของสสาร เกิดเป็นสารใหม่ขึ้นมา ทั้งนี้เพราะมีปฏิกิริยาเคมีเกิดขึ้นนั่นเอง การเปลี่ยนแปลงทางเคมี ได้แก่ การเผาไหม้ การย่อยอาหาร การเกิดสนิม การรวมตัวของโมเลกุลของสารต่างๆ เป็นต้น การเปลี่ยนแปลงทางเคมี ทำให้ได้สารใหม่เกิดขึ้นเสมอ ซึ่งสามารถเขียนเป็นสมการเคมีขึ้นแทนปฏิกิริยาเคมีที่เกิดขึ้นได้ ตัวอย่างของการเปลี่ยนแปลงทางเคมี เช่น การเกิดนมเปรี้ยว การปิ้งขนมปัง การเกิดสนิมของตะปู การจุดประกายของน้ำมันในเครื่องยนต์ การเกิดฟองของไฮโดรเจนเปอร์ออกไซด์ (H2O2) ในบาดแผล การจุดไม้ขีดไฟ การกินยาลดกรด เป็นต้น
– สถานะของสาร สารแบ่งออกเป็น 3 สถานะ คือ
1) ของแข็ง ( solid ) หมายถึง สารที่มีลักษณะรูปร่างไม่เปลี่ยนแปลง และมีรูปร่างเฉพาะตัว เนื่องจากอนุภาคในของแข็งจัดเรียงชิดติดกันและอัดแน่นอย่างมีระเบียบไม่มีการเคลื่อนที่หรือเคลื่อนที่ได้น้อยมาก ไม่สามารถทะลุผ่านได้และไม่สามารถบีบหรือทำให้เล็กลงได้ เช่น ไม้ หิน เหล็ก ทองคำ ดิน ทราย พลาสติก กระดาษ เป็นต้น
2) ของเหลว ( liquid ) หมายถึง สารที่มีลักษณะไหลได้ มีรูปร่างตามภาชนะที่บรรจุ เนื่องจากอนุภาคในของเหลวอยู่ห่างกันมากกว่าของแข็ง อนุภาคไม่ยึดติดกันจึงสามารถเคลื่อนที่ได้ในระยะใกล้ และมีแรงดึงดูดซึ่งกันและกัน มีปริมาตรคงที่ สามารถทะลุผ่านได้ เช่น น้ำ แอลกอฮอล์ น้ำมันพืช น้ำมันเบนซิน เป็นต้น
3) แก๊ส ( gas ) หมายถึง สารที่ลักษณะฟุ้งกระจายเต็มภาชนะที่บรรจุ เนื่องจากอนุภาคของแก๊สอยู่ห่างกันมาก มีพลังงานในการเคลื่อนที่อย่างรวดเร็วไปได้ในทุกทิศทางตลอดเวลา จึงมีแรงดึงดูดระหว่างอนุภาคน้อยมาก สามารถทะลุผ่านได้ง่าย และบีบอัดให้เล็กลงได้ง่าย เช่น อากาศ แก๊สออกซิเจน แก๊สหุงต้ม เป็นต้น
ในปี พ.ศ. 2348 ( ค.ศ. 1805 ) จอห์น ดาลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอแนวคิดว่า “ อนุภาคที่เล็กที่สุดของสารซึ่งไม่สามารถแบ่งย่อยให้เล็กลงได้อีก เรียกว่า อะตอม “ และต่อมานักวิทยาศาสตร์ได้ศึกษาค้นคว้าเกี่ยวกับอะตอมและอนุภาคของสารมากขึ้นทำให้ทราบว่าอนุภาคของสารที่สำคัญมี 3 ชนิด คือ
1. อะตอม ( atom ) เป็นอนุภาคของสารที่เล็กที่สุดที่อยู่ตามลำพังได้ยาก ดังนั้นอะตอมมักจะอยู่รวมกันเป็นอนุภาคที่ใหญ่ขึ้น เรียกว่า “ โมเลกุล “ เช่น อะตอมของออกซิเจน ( O ) จะรวมกันเป็นโมเลกุลของแก๊สออกซิเจน ( O2 ) , อะตอมของไฮโดรเจน( H ) รวมกับอะตอมของออกซิเจน ( O ) เป็นโมเลกุลของน้ำ ( H O2 ) เป็นต้น หรืออะตอมอาจรวมกันเป็นโครงสร้างขนาดใหญ่เรียกว่า “ โครงผลึกหรือผลึก “ เช่น คาร์บอน ( C ) จะอยู่รวมกันในธรรมชาติเป็นโครงผลึกขนาดใหญ่และมีความแข็งแรงมากในรูปของเพชรหรือแกรไฟต์
การศึกษาเกี่ยวกับอะตอมของธาตุนิยมใช้สัญลักษณ์แทนการเรียนชื่อธาตุโดยใช้อักษรตัวแรกและตัวอักษรถัดไปในภาษาอังกฤษหรือภาษาละติน แต่การอ่านชื่อธาตุอ่านเป็นภาษาอังกฤษเสมอ เช่น ธาตุไฮโดรเจน ชื่อภาษาอังกฤษ hydrogen สัญลักษณ์ H เป็นต้น
2. โมเลกุล ( molecule ) หมายถึงอนุภาคที่เล็กที่สุดของสารที่สามารถอยู่ในธรรมชาติได้อย่างอิสระ โมเลกุลเกิดจากอะตอมตั้งแต่ 2 อะตอมขึ้นไปมารวมกันในทางเคมี และเขียนแทนโมเลกุลด้วยสัญลักษณ์ของอะตอมที่มารวมกันนี้ว่า สูตรเคมี เช่น โมเลกุลของน้ำ สูตรโมเลกุล คือ H O2
3. ไอออน ( ion ) หมายถึงอะตอมหรือกลุ่มของอะตอมที่มีประจุไฟฟ้า มี 2 ชนิด คือ ไอออนบวก และไอออนลบ เช่น H – (ไฮโดรเจนไอออน ) , Na+ ( โซเดียมไอออน ) เป็นต้น
ประเภทของสารและการจำแนกประเภท
การจำแนกประเภทของสาร
ในการศึกษาเรื่องสาร จำเป็นต้องแบ่งสารออกเป็นหมวดหมู่ เพื่อให้ง่ายต่อการจดจำสาร โดยทั่วไปนิยมใช้สมบัติทางกายภาพด้านใดด้านหนึ่งของสารเป็นเกณฑ์ในการจำแนกสารซึ่งมีหลายเกณฑ์ด้วยกัน เช่น
1.ใช้สถานะเป็นเกณฑ์ จะแบ่งสารออกได้เป็น 3 กลุ่ม คือ
1.1 ของแข็ง ( solid )
1.2 ของเหลว ( liquid )
1.3 ก๊าซ ( gas )ใช้
2.ใช้ความเป็นโลหะเป็นเกณฑ์ แบ่งได้เป็น 3 กลุ่ม คือ
2.1 โลหะ ( metal)
2.2 อโลหะ ( non-metal)
2.3 กึ่งโลหะ ( metaliod )
3.ใช้การละลายน้ำเป็นเกณฑ์ แบ่งได้ 2 กลุ่ม คือ
3.1 สารที่ละลายน้ำ
3.2 สารที่ไม่ละลายน้ำ
4.ใช้เนื้อสารเป็นเกณฑ์ แบ่งออกเป็น 2 กลุ่ม คือ
4.1 สารเนื้อเดียว ( homogeneous substance )
4.2 สารเนื้อผสม ( heterogeneous substance )
สารเนื้อเดียว
สารเนื้อเดียว ( Homogeneous Substance ) หมายถึง สารที่มีลักษณะของเนื้อสารผสมกลมกลืนกันเป็นเนื้อเดียว และมีอัตราส่วนของผสมเท่ากัน ถ้านำส่วนใดส่วนหนึ่งของสารเนื้อเดียวไปทดสอบจะมีสมบัติเหมือนกันทุกประการ เช่น น้ำกลั่นและเกลือแกง เป็นสารเนื้อเดียว เมื่อนำเกลือแกงใส่ในน้ำแล้วคนให้ละลายจะได้สารละลายน้ำเกลือ ซึ่งเป็นสารเนื้อเดียวที่มีอัตราส่วนของน้ำและเกลือแกงเหมือนกันทุกส่วน
สารเนื้อเดียวมีได้ทั้ง 3 สถานะ คือ
1.สารเนื้อเดียวสถานะของแข็ง เช่น เหล็ก ทองคำ ทองแดง สังกะสี อะลูมิเนียม นาก ฟิวส์ ทองเหลือง หินปูน เกลือแกง น้ำตาลทราย เป็นต้น
2.สารเนื้อเดียวสถานะของเหลว เช่น น้ำกลั่น น้ำเกลือ น้ำส้มสายชู น้ำอัดลม น้ำมันพืช เอทานอล น้ำเชื่อม น้ำนม เป็นต้น
3.สารเนื้อเดียวสถานะแก๊ส เช่น อากาศ แก๊สหุงต้ม แก๊สออกซิเจน แก๊สไนโตรเจน แก๊สคาร์บอนไดออกไซด์ เป็นต้น
นักวิทยาศาสตร์จำแนกสารเนื้อเดียวออกเป็น 2 ประเภท คือ
1.สารบริสุทธิ์ ( Pure Substance ) เป็นสารเนื้อเดียวที่ประกอบด้วยสารเพียงอย่างเดียว ไม่มีสารอื่นเจือปน ได้แก่ ธาตุและสารประกอบ
2.สารไม่บริสุทธิ์ เป็นสารเนื้อเดียวที่ประกอบด้วยสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปด้วยอัตราส่วนที่ไม่แน่นอน ไม่มีปฏิกิริยาเคมีเกิดขึ้น สารที่เกิดใหม่จะมีสมบัติไม่คงที่ขึ้นอยู่กับปริมาณของสารบริสุทธิ์ที่นำมาผสมกัน ได้แก่ สารละลาย คอลลอยด์
ธาตุ ( Element ) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมเพียงชนิดเดียว ธาตุจึงไม่สามารถแบ่งย่อยลงไปได้อีกเนื่องจากอะตอมทั้งหมดในสารนั้นเป็นชนิดเดียวกัน อะตอมของธาตุบางชนิดอยู่รวมกันเป็นผลึก เช่น ธาตุเหล็ก ( Fe ) ธาตุทองคำ ( Au ) ธาตุสังกะสี ( Zn ) ธาตุเงิน ( Ag ) เป็นต้น ธาตุบางชนิดมีอะตอมอยู่รวมกันเป็นโมเลกุล เช่น ธาตุออกซิเจน ( O2 ) ธาตุไนโตรเจน (N2 ) ธาตุคลอรีน (Cl2 ) ธาตุฟอสฟอรัส (P4 )ธาตุกัมมะถัน (S8 ) เป็นต้น ธาตุบางชนิดอะตอมจะอยู่อย่างอิสระเพียงลำพัง เช่น ธาตุฮีเลียม ( He ) ธาตุนีออน ( Ne ) และธาตุอาร์กอน ( Ar ) ซึ่งจัดเป็นธาตุเฉื่อย
นักวิทยาศาสตร์ใช้สมบัติทางกายภาพจำแนกธาตุออกเป็น 3 กลุ่ม คือ
1.โลหะ ( Metals ) เป็นธาตุที่มีมากที่สุดส่วนใหญ่มีสถานะของแข็งที่อุณหภูมิห้อง ยกเว้นปรอท มีสมบัติทั่วไป คือ นำความร้อนได้ดี มีความเหนียว นำไฟฟ้าได้ดี ผิวเป็นมันวาว สะท้อนแสงได้ ตีเป็นแผ่นบางได้ เช่น เหล็ก ทองคำ เงิน เป็นต้น
2. อโลหะ ( Nonmetals ) เป็นธาตที่มีจำนวนมากรองลงมาจากโลหะมีทั้งสถานะของแข็ง ของเหลวและแก๊ส แต่ส่วนใหญ่จะมรสถานะแก๊สที่อุณหภูมิห้อง มีสมบัติตรงกันข้ามกับโลหะ เช่น ไฮโดรเจน ออกซิเจน ไนโตรเจน คลอรีน เป็นต้น
3. กึ่งโลหะ (Metalloids ) อาจเรียกได้ว่าสารกึ่งตัวนำ ( Semiconductors ) เป็นธาตุที่มีจำนวนน้อยมากมีสมบัติของโลหะและอโลหะอยู่ในธาตุเดียวกัน เช่น พลวง สารหนู ซิลิคอน โบรอน เป็นต้น
สารประกอบ
สารประกอบ ( Compound ) เป็นสารบริสุทธิ์ที่ประกอบด้วยอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมกันทางเคมีด้วยอัตราส่วนที่คงที่เกิดเป็นสารชนิดใหม่ที่มีสมบัติแตกต่างไปจากเดิมอย่างเด่นชัด เช่น โซเดียม ( Na ) เป็นโลหะสีเงินอ่อน-ขาวทำปฏิกิริยากับน้ำ กับ คลอรีน ( Cl ) เป็นแก๊สพิษสีเหลือง-อมเขียว มีกลิ่นฉุนว่องไวต่อปฏิกิริยา เมื่อนำมารวมกันทางเคมี จะได้โซเดียมคลอไรด์ ( NaCl ) หรือเกลือแกง ซึ่งเป็นของแข็งสีขาว รสเค็ม ละลายน้ำได้ดี รับประทานได้ เป็นต้นโดยทั่วไปสัญญลักษณ์ที่ใช้เขียนแทนชื่อสารประกอบจะอยู่ในรูปของสูตรโมเลกุล
คอลลอยด์
คอลลอยด์ ( Colloid ) เป็นสารเนื้อเดียวที่เกิดจากการรวมตัวกันทางกายภาพของสารตั้งแต่ 2 ชนิดขึ้นไป มีลักษณะมัวหรือขุ่น ไม่ตกตะกอน ขนาดของอนุภาคมีเส้นผ่าศุนย์กลางประมาณ10 – 7 ถึง 10 – 4 เซนติเมตร สามารถลอดผ่านกระดาษกรองได้ แต่ไม่สารลอดผ่านกระดาษเซลโลเฟนได้เมื่อผ่านลำแสงดเข้าไปในคอลลอยด์ จะเกิดการกระเจิงของแสง ทำให้มองเห็นลำแสงได้อย่างชัดเจน เรียกว่าปรากฏการณ์ทินดอลล์ ( Tyndall Effect ) ซึ่งค้นพบโดยนักวิทยาศาสตร์ชาวไอร์แลนด์ ชื่อ จอนห์ ทินดอลล์ เมื่อปี พ.ศ. 2412
ปรากฏการณ์ทินดอลล์ที่พบเห็นในชีวิตประจำวัน ได้แก่ลำแสงที่เกิดจากแสงอาทิตย์ส่องผ่านรูเล็กๆ หรือรอยแตกของฝาผนังบ้านผ่านฝุ่นละอองในอากาศลำแสงที่เกิดจากไฟฉาย ไฟรถยนต์หรือสปอตไลต์ส่องผ่านกลุ่มหมอก ควัน หรือฝุนละอองในอากาศ
อิมัลชั่น ( Emulsion ) หมายถึง คอลลอยด์ที่เกิดจากของเหลว 2 ชนิดที่ไม่รวมเป็นเนื้อเดียวกัน แต่เมื่อเขย่าด้วยแรงที่มากพออนุภาคของของเหลวทั้ง 2 จะแทรกกันอยู่ได้เป็นคอลลอยด์ แต่เมื่อตั้งทิ้งไว้ระยะหนึ่งของเหลวทั้ง 2 จะแยกออกจากกันเหมือนเดิม การที่จะทำให้อิมัลชันอยู่รวมเป็นเนื้อเดียวกันต้องเติมสารที่ทำหน้าที่เป็นตัวประสาน ซึ่งเรียกว่า อิมัลซิฟายเออร์ ( Emulsifler ) เช่นคราบน้ำมันในจานอาหาร เมื่อนำไปล้างจะเกิดอิมัลชัน ซึ่งประกอบด้วยน้ำและน้ำมัน แต่งเมื่อใช้น้ำยาล้างจานเป็นอิมัลซิฟายเออร์ ก็จะสามารถล้างจานได้น้ำสลัด มีสาวนผสมของน้ำมันพืชกับน้ำส้มสายชู มีไข่แดงเป็นอิมัลซิฟายเออร์การย่อยไขมันในลำไส้เล็ก มีไขมันกับเอนไซม์ ( น้ำย่อย ) เป็นอิมัลชัน โดยมีน้ำดีเป็นอิมัลซิฟายเออร์
สารละลาย ( Solution )
หมายถึง สารเนื้อเดียวที่ไม่บริสุทธิ์ เกิดจากการรวมกันทางกายภาพของสารบริสุทธิ์ตั้งแต่ 2 ชนิดขึ้นไปในอัตราส่วนที่ไม่แน่นอน โดยยังคงสมบัติของสารเดิมไว้สารละลายประกอบด้วย ตัวทำละลาย ( Solvent ) ตัวถูกละลาย ( Solute ) ซึ่งรวมอยู่เป็นเดียวอาจอยู่ในรูปของแข็ง ของเหลวหรือแก๊สก็ได้
สารเนื้อผสม
สารเนื้อผสม ( Heterogeneous Substance ) หมายถึง สารที่มีลักษณะของเนื้อสารคละกัน ไม่ผสมกลมกลืนเป็นเนื้อเดียวกัน สารที่เป็นส่วนผสมแต่ละชนิดก็ยังคงแสดงสมบัติของสารเดิม เพราะเป็นการรวมกันทางกายภาพไม่มีการเปลี่ยนแปลงทางเคมีเกิดขึ้น เราสามารถใช้ตาเปล่าสังเกตและจำแนกได้ว่าสารเนื้อผสมนั้นประกอบด้วยสารใดบ้าง และสามารถแยกสารเหล่านั้นออกจากกันได้โดยวิธีทางกายภาพธรรมดา โดยไม่ทำให้สมบัติเดิมเปลี่ยนแปลงไป
สารเนื้อผสมมีได้ทั้ง 3 สถานะ เช่น
1. สารเนื้อผสมสถานะของแข็ง เช่น ทราย คอนกรีต ดิน เป็นต้น
2. สารเนื้อผสมสถานะของเหลว เช่น น้ำคลอง น้ำโคลน น้ำจิ้มไก่ เป็นต้น
3. สารเนื้อผสมสถานะแก๊ส เช่น ฝุ่นละอองในอากาศ เขม่า ควันดำในอากาศ เป็นต้น
สารแขวนลอย
สารแขวนลอย ( Suspension ) สารแขวนลอยเป็นสารผสมที่อนุภาคของแข็งมีขนาดใหญ่กว่า เซนติเมตร แขวนลอยอยู่ในตัวกลางที่เป็นของเหลว มีลักษณะเป็นสารเนื้อผสมที่อนุภาคไม่รวมเป็นเนื้อเดียวกัน สามารถมองเห็นสารผสมได้อย่างชัดเจน อาจแขวนลอยอยู่ในของเหลวหรือตกตะกอนเมื่อตั้งทิ้งไว้
อนุภาคของสารแขวนลอยไม่สามารถผ่านกระดาษกรองและกระดาษเซลโลเฟนได้ เช่น ผงถ่านในน้ำ น้ำคลอง น้ำโคลน น้ำส้มค้น น้ำจิ้มไก่ แป้งมันในน้ำ เป็นต้น