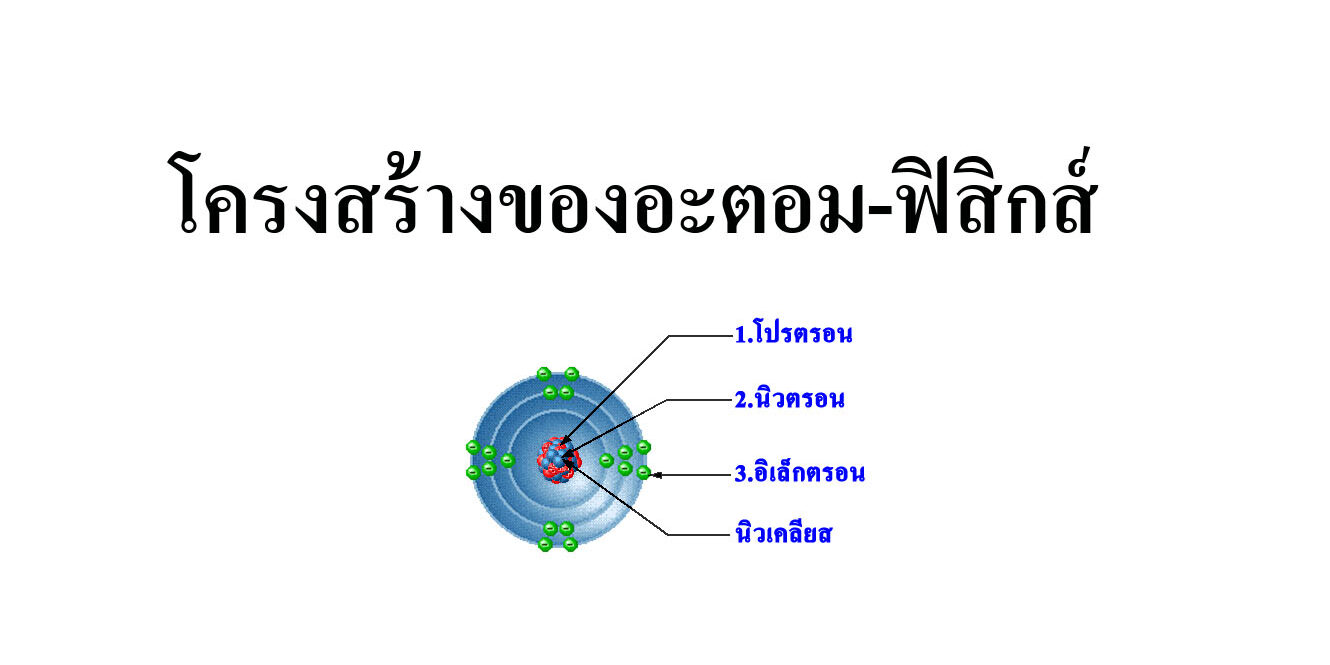
โครงสร้างของอะตอม
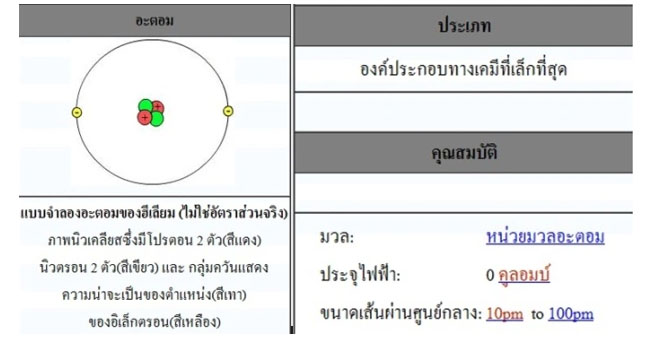
อะตอม เป็นโครงสร้างขนาดเล็กมากมองด้วยตาเปล่าไม่เห็น ที่พบได้ในสิ่งของทุก ๆ อย่างรอบตัวเรา อะตอมประกอบไปด้วยอนุภาค 3 ชนิด คือ: อิเล็กตรอน ซึ่งมีประจุลบโปรตอน ซึ่งมีประจุบวกนิวตรอน ซึ่งไม่มีประจุ
อิเล็กตรอน
อิเล็กตรอน (Electron) เป็นอนุภาค ที่มีประจุไฟฟ้า เป็นลบวิ่งอยู่รอบๆ นิวเคลียส โดยปกติ จำนวน อิเล็กตรอน ในอะตอมที่เป็นกลางทางไฟฟ้าจะมีเท่ากับจำนวน โปรตอน เช่น ไฮโดรเจน มีโปรตอน 1 ตัว และอิเล็กตรอน 1 ตัว ฮีเลียม มีโปรตอน 2 ตัว และอิเล็กตรอน 2 ตัว
โปรตรอน
โปรตรอน (Proton) คืออนุภาคที่มีประจุไฟฟ้าเป็นบวกอยู่ในนิวเคลียสหรือใจกลางของธาตุ ธาตุเดียวกันจะมีจำนวนโปรตอนเท่ากัน เช่นไฮโดรเจน เป็นธาตุตัวที่ 1 เบาที่สุดมีโปรตอนตัวเดียว โปรตอนเกิดจากควาร์ก up 2 และ down 1 มีประจุ +1.60×10^(-19)คูลอมบ์ มีน้ำหนัก 1.67×10^(-27) กิโลกรัม ฮีเลียม มี 2 ตัว เหล็กมี 26 ตัว ยูเรเนียม มี 92 ตัว
นิวตรอน
นิวตรอน (Neutron) เป็นอนุภาคที่เป็นกลางไม่มีประจุไฟฟ้าอยู่ในนิวเคลียสมีจำนวนใกล้เคียงกับโปรตอนแต่อาจแตกต่างกันได้เช่นในฮีเลียมมีนิวตรอน 2 ตัว เท่ากับโปรตอนแต่ในเหล็กมี 30 ตัว และในยูเรเนียมมีนิวตรอนถึง 146 ตัว นิวตรอนอาจเกิดจากการอัดอีเล็กตรอนกับโปรตอนดังเช่นในดาวฤกษ์มวลมาก นิวตรอนเกิดจากควาร์ก up 1 อนุภาค และ ควาร์ก down 2 อนุภาค มีน้ำหนัก 1.67×10^(-27)ซึ่งเท่ากันโปรตอน
อะตอมเป็นองค์ประกอบพื้นฐานทางเคมีซึ่งไม่เปลี่ยนแปลงตามปฏิกิริยาเคมี ธาตุที่พบได้ตามธรรมชาติบนโลกนี้นั้นมีปรากฏอยู่ประมาณ 90 ชนิดเท่านั้น (นอกเหนือจากนี้มี ธาตุบางชนิดเช่นเทคนิเซียม และ แคลิฟอร์เนียม ที่พบได้ในซูเปอร์โนวา และธาตุที่เลขอะตอม สูง (มากกว่า 100 ขึ้นไป) ที่สามารถสังเคราะห์ได้จาก การนำอะตอมมาชนกันด้วยความเร็วสูง)
เราเรียกอะตอม สองอะตอมว่าเป็นธาตุเดียวกันก็ต่อเมื่อ อะตอมสองอันนั้นมีจำนวนโปรตอนเท่ากัน โดยทั่วไปแล้ว ธาตุ แต่ละธาตุไม่เหมือนกัน อะตอมของธาตุชนิดเดียวกันอาจมีจำนวนนิวตรอนที่แตกต่างกัน เราเรียกสองอะตอมที่มีจำนวนโปรตรอนเท่ากันแต่จำนวนนิวตรอนแตกต่างกันนั้นจะเรียกว่าเป็นไอโซโทป (isotope)
นอกจากธาตุที่เกิดตามธรรมชาติแล้ว ยังมีธาตุที่ถูกสร้างขึ้น แต่ธาตุเหล่านี้มักจะไม่เสถียร และ สลายไปเป็นธาตุอื่นที่เสถียร โดยกระบวนการสลายกัมมันตรังสี ตัวอย่างเช่น Beta Decay ,Double Beta Decay , Beta Capture , Gamma Decay และอื่น ๆ
ถึงแม้ว่าจะมีธาตุที่เกิดตามธรรมชาติเพียง 90 ชนิด อะตอมของธาตุเหล่านี้สามารถสร้างพันธะทางเคมี รวมกันเป็นโมเลกุล และองค์ประกอบชนิดอื่นๆ โมเลกุลเกิดจากการรวมตัวกันของอะตอมหลายอะตอม เช่น โมเลกุลของน้ำเกิดจากการรวมตัวกันของอะตอมไฮโดรเจน 2 อะตอม และ อะตอมออกซิเจน 1 อะตอม
เนื่องจากอะตอมเป็นสิ่งที่มีอยู่ไปทั่วทุกที่ จึงเป็นหัวข้อศึกษาที่ได้รับความสำคัญในหลายศตวรรษที่ผ่านมา หัวข้อวิจัยทางด้านอะตอมในปัจจุบันจะเน้นทางด้าน quantum effects เช่น ของเหลวผลควบแน่นโบส-ไอน์สไตน์