สมบัติของแก๊ส
โดยทั่ว ไปสสารแบ่งออกเป็ น 3 สถานะ คือ ของแข็ง ของเหลว และแก๊ส สถานะแก๊สเป็นสถานะที่ง่ายที่สุดที่สามารถอธิบายได้ท้งัทางทฤษฎีและทางการทดลองการศึกษาเกี่ยวกับ เรื่องของสารต่างๆ ในสถานะแก๊สน้ีจะสามารถให้ข้อมูลและตัวอย่างของวิธีการทางวิทยาศาสตร์ได้เป็นอย่างดีนอกจากจะแสดงให้เห็นถึงปฏิกิริยาเคมีที่เกิดข้ึนแลว้ยงัสามารถนา ไปสู่การคำนวณทาง
ปริมาณสารสัมพันธ์ได้อีกด้วยลักษณะของแก๊ส คือไม่มีรูปร่างหรือปริมาตรที่แน่นอน มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยทำให้มีการฟุ้งกระจาย เพราะโมเลกุลมีการเคลื่อนที่ด้วยความเร็ว และไม่มีทิศทางที่แน่นอน เมื่อ
เคลื่อนที่ไปชนผนังภาชนะ จะท าให้เกิดความดัน สามารถถูกอัดได้ง่ายและมากกว่าของเหลว ถ้าแก๊สมีการเปลี่ยนอุณหภูมิและความดัน จะท าให้ปริมาตรเปลี่ยนแปลง โดยปริมาตรของแก๊สจะมี
ส่วนผกผันกับความดันที่มากระท า และเมื่อนำแก๊สหลายชนิดมาใส่ในภาชนะเดียวกัน จะเกิดการรวมกันเป็นเนื้อเดียวอยา่ งสมบูรณ์(ทบวงมหาวิทยาลัย,2541)คุณสมบัติบางประการของแก๊สที่แตกต่างจาก ของแข็งและ ของเหลว คือ
1)แก๊สมีลักษณะโปร่งใส
2) มีความหนาแน่นน้อยกว่าของแข็งและของเหลว
3)รูปร่างและปริมาตรไม่แน่นอน ข้ึนอยกู่ บั ภาชนะที่บรรจุ
4)อนุภาคของแก๊สอยู่ห่างกันมากกว่าของแข็งและของเหลว
5) เมื่อมีการเปลี่ยนแปลงอุณหภูมิ ปริมาตรของแก๊สจะเปลี่ยนแปลงได้มากกว่าของแข็ง
และของเหลว
6) แก๊สสามารถถูกอัดได้มากกว่าของเหลว
นักวิทยาศาสตร์ไดร้ิเริ่มศึกษาเกี่ยวกบัแก๊สอยา่งเป็นรูปแบบในปี ค.ศ.1660 Robert Boyle ได้
ท าการศึกษาเกี่ยวกับความดันของแก๊ส โดยคิดว่าอากาศเป็ นอนุภาคเล็กที่มีมวลและมีการยืดหดได้
ซึ่งต่อมาได้กลายเป็ นกฎที่เรียกว่า กฎของบอยล์ ในระหว่างปี ค.ศ.1805 –1815 Joseph Louis GayLussac ได้ศึกษาการรวมตัวโดยปริ มาตรของแก๊สชนิดหนึ่ ง แล้วได้แก๊สอีกชนิดหนึ่ ง และผล
การศึกษาน้ีไดร้ับการยืนยนัโดยสมมติฐานของอาโวกาโดร (Amaedeo Avogadro, 176 – 1856)
ตัวแปรที่สำคัญของแก๊ส
จากที่กล่าวมาแล้วข้างต้น ตัวแปรที่มีความส าคัญในการศึกษาพฤติกรรมของแก๊ส คือ
ปริมาตร อุณหภูมิ และความดัน
1.2.1 ปริมาตรของแก๊ส (Volume; V)
เนื่องจากโมเลกุลของแก๊ส มีการเคลื่อนที่อย่างอิสระ และมีการฟุ้งกระจายเต็มภาชนะที่
บรรจุ ดังน้ัน ปริมาตรของแก๊สจึงหมายถึง ปริมาตรของภาชนะที่บรรจุแก๊สน้ันๆ หน่วยของ
ปริมาตรที่ใช้ แสดงในตารางที่ 1.1
1.2.3 อุณหภูมิ(Temperature; T)
อุณหภูมิในที่น้ีคืออุณหภูมิของแก๊สที่บรรจุในภาชนะเครื่องมือที่ใชว้ดัอุณหภูมิมีหลาย
ชนิด ได้แก่ เทอร์มอมิเตอร์(Thermometer) เทอร์มอคัปเปิ ล(Thermocouple) และมาตรอุณหภูมิสูง
(Pyrometer) โดยเครื่องมือที่นิยมและง่ายต่อการใช้วัดอุณหภูมิ คือ เทอร์มอมิเตอร์
หน่วยของอุณหภูมิมีหลายแบบ ข้ึนกบั เครื่องมือที่ใชว้ดั เช่น องศาเซลเซียส (oC) องศา
ฟาเรนไฮด์(oF) และ เคลวิน (K) เป็นต้น ในการศึกษาเกี่ยวกับแก๊ส นิยมใช้หน่วย เคลวิน ซึ่งมี
ความสัมพันธ์กับหน่วยองศาเซลเซียส ดังนี้ K = 273.15 + oC
ปริมาตร อุณหภูมิ และความดัน
การวัดปริมาตรของแก๊ส เนื่องจากแก๊สบรรจุในภาชนะใดก็พุ่งกระจายเต็มภาชนะ ดั้งนั้น ปริมาตรของแก๊ส จึงมักหมายถึงปริมาตรของภาชนะที่บรรจุแก๊สนั้น
หน่วยของปริมาตร หน่วยของปริมาตร ที่นิยมใช้คือ ลูกบาศก์เดซิเมตร (DM3) หรือลิตร (LITRE) หรือ ลูกบาศก์เซนติเมตร (CM3) (1 DM3 =1000 CM3)
อุณหภูมิ (TEMPERATURE) เป็นมาตราส่วนที่ใช้บอกระดับความร้อน-เย็นของสาร แต่อุณหภูมิไม่ได้บอกให้ทราบถึงปริมาตรความร้อนของสาร กล่าวคือ สารที่มีอุณหภูมิเท่ากันแสดงว่ามีระดับความร้อนเท่ากันแต่อาจจะมีปริมาตรความร้อนเท่ากันก็ได้ เครื่องมือวัดอุณหภูมิที่ใช้กันอย่างแพร่หลายคือเทอร์โมมิเตอร์
การวัดอุณหภูมิของแก๊ส การวัดอุณหภูมิมาตราส่วนที่ใช้มีหลายแบบ คือ เซลเซียส
เคลวิน ฟาเรนไฮต์ โรเมอร์และแรงกิน แต่การวัดอุณหภูมิของแก๊สส่วนใหญ่ใช้ มาตราส่วนเคลวิน
(KELVIN SCALE) หรือเรียกว่า มาตราส่วนสัมบูรณ์ (ABSOLUTE TEMPERATURE SCALE) สัญลักษณ์ K และองศาเซลเซียส
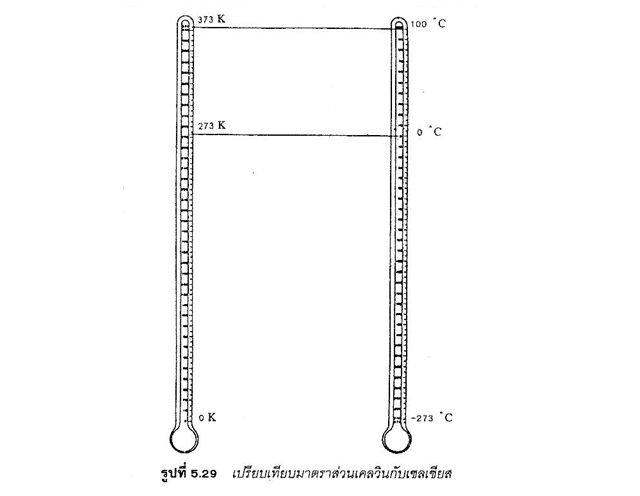
อุณหภูมิเคลวิน และองศาเซลเซียสมีความสัมพันธ์กันดังนี้
อุณหภูมิเคลวิน = องศาเซลเซียส + 273.15 เช่น27 องศาเซลเซียส เท่ากับ 300.15 K หาได้ดังนี้อุณหภูมิเคลวิน = 27 + 273.15 = 300.15 K
หมายเหตุ เพื่อความสะดวกในการคำนวณอาจใช้ 273 (ค่าโดยประมาณ) แทน 273.15 การวัดอุณหภูมิของแก๊สส่วนใหญ่ใช้อุณหภูมิเคลวิน (K) เพราะปริมาตรของแก๊สแปรผันตรงกับอุณหภูมิ
ความดัน (PRESSURE) หมายถึง แรงที่กระทำต่อหน่วยพื้นที่ ที่ตั้งฉากกับแรงนั้น เนื่องจากความดันของแก๊สเกิดจากโมเลกุลของแก๊สชนผันงภาชนะ เพราะฉะนั้นความดันของแก๊สคือแรงที่โมเลกุลของแก๊สกระทำต่อผนังต่อหนึ่งหน่วนพื้นที่ของภาชนะ และความดันของแก๊สมีค่าเท่ากันหมดไม่ว่าจะวัดที่ส่วนใดของภาชนะ
เครื่องมือวัดความดันของแก๊ส เครื่องมือที่ใช้วัดความดันของแก๊สเรียกว่า มาโนมิเตอร์ (MANOMETER) ซึ่งมีอยู่ 2 ชนิด คือ
1. ชนิดปลายปิด
2. ชนิดปลายเปิด
ชนิดปลายปิด และปลายเปิด มีลักษณะดังรูป
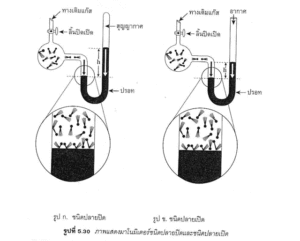
จากรูป ก. เพราะว่าที่ว่างเหนือปรอทเป็นสุญญากาศ
ดังนั้น ความดันของแก๊ส = H มิลลิเมตรปรอท (MMHG)
จากรูป ข. เพราะว่าปลายข้างเปิดมีความดันของบรรยากาศกดบนปรอท
ดังนั้น ความดันของแก๊ส = ความดันของบรรยากาศ + H มิลิเมตรปรอท (MMHG)
สมบัติทั่วไปของแก็ส สมบัติทั่วไปของแก๊ส ได้แก่
1. แก๊สมีรูปร่างเป็นปริมาตรไม่แน่นอน เปลี่ยนแปลงไปตามภาชนะที่บรรจุ บรรจุ ในภาชนะใดก็จะมีรูปร่างเป็นปริมาตรตามภาชนะนั้น เช่น ถ้าบรรจุในภาชนะทรงกลมขนาด 1 ลิตร แก๊สจะมีรูปร่างเป็นทรงกลมมีปริมาตร 1 ลิตร เพราะแก็สมีแรงยึดเหนี่ยวระหว่างอนุภาค (โมเลกุล หรืออะตอม) น้อยมาก จึงทำให้อนุภาคของแก๊สสามารถเคลื่อนที่หรือแพร่กระจายเต็มภาชนะที่บรรจุ
2. ถ้าให้แก๊สอยู่ในภาชนะที่เปลี่ยนแปลงปริมาตรได้ ปริมาตรของแก๊สจะขึ้นอยู่กับอุณหภูมิ ความดันและจำนวนโมล ดังนั้นเมื่อบอกปริมาตรของแก๊สจะต้องบอกอุณหภูมิ ความดันและจำนวนโมลด้วย เช่น แก๊สออกซิเจน 1 โมลมีปริมาตร 22.4 dm3;ที่อุณหภูมิ 0 C ความดัน 1บรรยากาศ (STP)
3. สารที่อยู่ในสถานะแก๊สมีความหนาแน่นน้อยกว่าเมื่ออยู่ในสถานะของเหลวและของแข็งมาก เช่น ไอน้ำ มีความหนาแน่น 0.0006 g/cm3แต่น้ำมีความแน่นถึง 0.9584 g/cm3;ที่100 C
4. แก๊สสามารถแพร่ได้ และแพร่ได้เร็วเพราะแก็สมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าของเหลวและของแข็ง
5. แก็สต่างๆ ตั้งแต่ 2 ชนิดขึ้นไปเมื่อนำมาใส่ในภาชนะเดียวกัน แก๊สแต่ละชนิดจะแพร่ผสมกันอย่างสมบูรณ์ทุกส่วน นั้นคือส่วนผสมของแก๊สเป็นสารเดียว หรือเป็นสารละลาย (Solution)
6. แก๊สส่วนใหญ่ไม่มีสีและโปร่งใส่เช่นแก๊สออกซิเจน(O2)แก๊สไฮโดเจน(H2) แก๊สคาร์บอนไดออกไซด์(CO2)แต่แก๊สบางชนิดมีสี เช่น แก๊สไนโตเจนไดออกไซด์ (NO2) มีสีน้ำตาลแดง แก๊สคลอรีน(Cl2) มีสีเขียวแกมเหลือง แก๊สโอโซน (O3) ที่บริสุทธิ์มีสีน้ำเงินแก่ เป็นต้น






