ในที่สุด ผลงานของแมกซ์เวลล์และโบลต์ซมานน์ และนักวิทยาศาสตร์อีกหลายคน ก็ได้กลายเป็นทฤษฎีสำคัญที่ใช้อธิบายพฤติกรรมของแก๊ส เรียกว่าทฤษฎีจลน์โมเลกุลของแก๊ส หรือเรียกว่า ทฤษฎีจลน์ของแก๊ส
ทฤษฎีจลน์โมเลกุลของแก๊สมีเนื้อหาสรุปบนสมมติฐานต่างๆ ได้ดังนี้
2. โมเลกุลของแก๊สมีการเคลื่อนที่ตลอดเวลา การเคลื่อนที่ของโมเลกุลเป็นแบบสุ่ม และเกิดการชนกันระหว่างโมเลกุลแก๊สบ่อยครั้งมาก
2.อัตราเร็วของโมเลกุลแก๊ส

กฎของชาร์ล (Charles , s law)
ในปี ค.ศ. 1778 (พ.ศ.2321 หลังจากการค้นพบของบอยล์ 116 ปี) จ๊าก–อาเล็กซองเดร์–เซซา ชาร์ล (Jacqes A.C. Charles) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้ศึกษาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรของแก๊ส ที่มีจำนวนโมลและความดันคงที่ พบว่าปริมาตรของแก๊สแปรผันตรง ( varies directly ) กับอุณหภูมิเคลวิน และอัตราส่วนระหว่าง ปริมาตร : อุณหภูมิ เป็นค่าคงที่ ; (n , P คงที่ , V แปรผันตรงกับ T เคลวิน ) ;
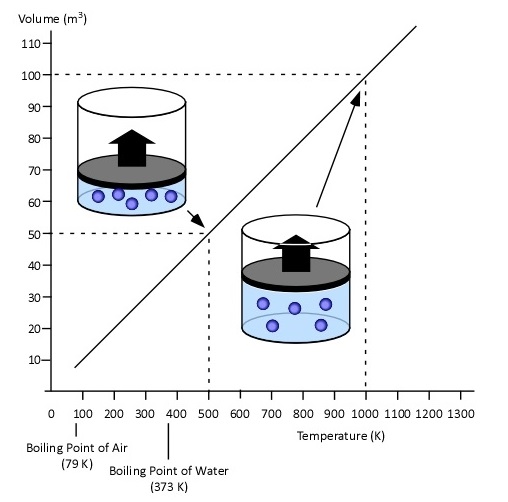
![]()
ตัวอย่างผลการทดลอง
|
การทดลองครั้งที่ |
V (cm3) |
T ( K ) |
V/T (cm3/K) |
|
1 |
100 |
283 |
0.35 |
|
2 |
114 |
323 |
0.35 |
|
3 |
132 |
373 |
0.35 |
|
4 |
167 |
473 |
0.35 |
เขียนแสดงในรูปของสัญลักษณ์
– ปริมาตรแปรผันตรงกับอุณหภูมิ เขียนว่า T
– อัตราส่วนระหว่าง ปริมาตร : อุณหภูมิ เป็นค่าคงที่ เขียนว่า
เมื่อมีการทดลองซ้ำหลาย ๆ ครั้ง จำนวน จึงมีหลายครั้งด้วย เช่น
สมการเพื่อการคิดคำนวณด้วยกฎของชาร์ลคือ
* V1 กับ V2 ต้องเป็นหน่วยเดียวกัน อาจเป็น dm3 , cm3 หรือหน่วยปริมาตรอื่น ๆ ก็ได้
* T1 กับ T2 ต้องเป็นอุณหภูมิเคลวินเสมอ
ตัวอย่าง ใช้ Mg จำนวน 1.00 โมล ทำปฏิกิริยากับสารละลายกรด HCl ซึ่งมากเกินพอ เกิดปฏิกิริยาดังสมการ : Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
– ถ้าทดลองที่ภาวะ STP จะได้ H2 กี่ dm3
– ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 1.00 atm จะได้ H2 กี่ dm3
วิธีทำ จากสมการ ; จำนวนโมลของ H2 ที่ได้ = จำนวนโมลของ Mg ที่ใช้
= 1.00 โมล
– ถ้าทดลองที่ภาวะ STP จะได้ H2 1.00 x 22.4 = 22.4 dm3 ตอบ
– ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 1.00 atm จะได้ H2 กี่ dm3 ต้องคิดด้วยกฎของชาร์ล
** คำถาม แก๊ส H2 จำนวน 22.4 dm3 กับแก๊ส H2 จำนวน 24.62 dm3 ที่คำนวณได้ มีจำนวนโมลเท่ากันหรือไม่
-ชอบคุณข้อมูล http://7fouy.blogspot.com/p/kinetic-theory-of-gases_27.html






