ตารางธาตุ
ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษาในแต่ละส่วนของตารางธาตุ โดยคาบ ( Period ) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ ( Group ) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งการจัดเรียงธาตุตามตารางธาตุยังสามารถช่วยอธิบายความสัมพันธ์ของสมบัติธาตุต่างๆ รวมถึงการทำนาย หรือคาดการณ์ ถึงคุณสมบัติทางเคมี และพฤติกรรมของธาตุ ที่ยังไม่ถูกค้นพบ หรือได้รับการสังเคราะห์ขึ้นใหม่อีกด้วย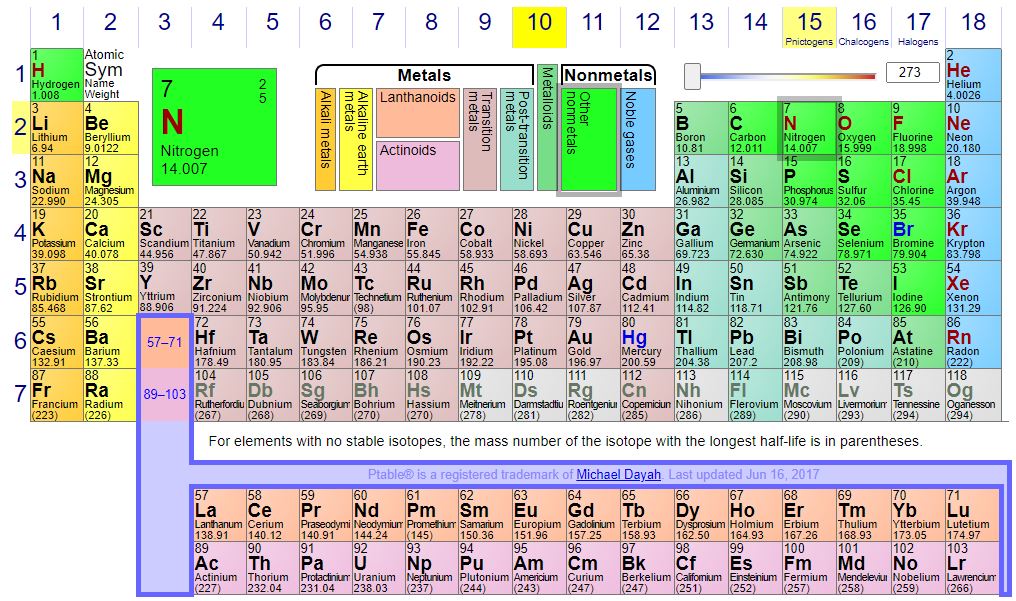
ตารางธาตุภาษาอังกฤษ
ธาตุ (Element) คือ โครงสร้างพื้นฐานของสสาร เป็นสารบริสุทธิ์ที่ไม่สามารถแยกย่อยได้อีกด้วยกระบวนการทางเคมี ธาตุเกิดขึ้นจากการรวมตัวกันของอนุภาคขนาดเล็กที่เรียกว่า “อะตอม” (Atom) ซึ่งธาตุเป็นการรวมตัวกันของอะตอมชนิดเดียวกัน
ตารางธาตุ นั้นมีความสำคัญมากๆ กับนักวิทยาศาสตร์หรือผู้ที่กำลังศึกษาค้นคว้าเกี่ยวกับโครงสร้างอะตอม อย่างเช่น ทอมป์สัน,แอสตัน, รัทเทอร์ฟอร์ด และ ฯลฯ อีกทั้งยังใช้ในการเรียนการสอนของวิชาเคมีอีกด้วย ผู้ที่เรียนจะเข้าใจและเห็นภาพมากขึ้นเมื่อได้ศึกษาเรื่องสมบัติทางเคมีและกายภาพของธาตุต่างๆ เพราะจะเข้าใจถึงคุณสมบัติของธาตุที่มีความคล้ายคลึงกัน
ประเภทของธาตุในตารางธาตุ (สรุป เรื่อง ตารางธาตุ)
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
คุณสมบัติของธาตุต่างๆ : สมบัติของธาตุในแต่ละหมู่ (ตารางธาตุภาษาไทย)
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal) สมบัติของธาตุโลหะ
– โลหะ อัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
– เป็นโลหะอ่อน ใช้มีดตัดได้
– เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
– เมื่อเป็นไอออน จะมีประจุบวก
– มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
– มีเวเลนซ์อิเล็กตรอน = 1
สมบัติของธาตุตามตารางธาตุ
1. สถานะของธาตุ
ธาตุในตารางธาตุมีทั้งสถานะของแข็ง ของเหลว และแก๊ส เช่น ธาตุในหมู่ VIIIA มีสถานะเป็นแก๊สทุกธาตุ เรียกว่า แก๊สเฉื่อย หรือ แก๊สมีตระกูล ได้แก่ He, Ne, Ar, Kr, Xe และ Rn เป็นธาตุที่เสถียร ในสภาวะปกติจะไม่เกิดปฏิกิริยากับธาตุชนิดอื่น (แต่ปัจจุบันสามารถเตรียมสารประกอบของธาตุ Kr กับ Xe ได้) ธาตุที่มีสถานะเป็นของเหลว ได้แก่ Hg และ Br ธาตุโลหะส่วนใหญ่มีสถานะเป็นของแข็ง
2. ความเป็นโลหะและอโลหะของธาตุ
ธาตุที่เป็นโลหะอยู่ทางซ้าย และธาตุที่เป็นอโลหะอยู่ทางขวาของตารางธาตุ สมบัติความเป็นโลหะของธาตุลดลงจากซ้ายไปขวา ธาตุที่มีความเป็นโลหะมากที่สุด ได้แก่ ธาตุหมู่ IA ธาตุที่มีความเป็นอโลหะมากที่สุดได้แก่ ธาตุหมู่ VIIIA แต่ธาตุหมู่ VIIA เป็นอโลหะที่ว่องไวในการทำปฏิกิริยามากที่สุด ธาตุหมู่เดียวกันจะมีความเป็นโลหะเพิ่มขึ้นจากบนลงล่าง
ธาตุที่มีสมบัติบางประการคล้ายโลหะ และสมบัติบางประการคล้ายอโลหะ จัดเป็นธาตุกึ่งโลหะ ได้แก่ ธาตุที่อยู่ติดกับเส้นซิกแซ็กของตารางธาตุ
3. ความว่องไวของการเกิดปฏิกิริยา
ธาตุหมู่ IA ชื่อ โลหะแอลคาไลน์ มีความว่องไวในการเกิดปฏิกิริยามากกว่าหมู่ IIA ที่เรียกว่า โลหะแอลคาไลน์เอิร์ท ส่วนธาตุหมู่ VIIA ชื่อแฮโลเจน เป็นอโลหะที่มีความว่องไวในการเกิดปฏิกิริยามากที่สุด
4. ความสัมพันธ์ระหว่างเวเลนซ์อิเล็กตรอนกับสมบัติของธาตุในตารางธาตุ
อะตอมของธาตุที่เป็นกลางทางไฟฟ้า จะมีจำนวนอิเล็กตรอนเท่ากับเลขอะตอม
ตารางธาตุ (Periodic table of elements) คือ ตารางที่นักวิทยาศาสตร์ได้รวบรวมธาตุต่างๆ ไว้เป็นหมวดหมู่ตามลักษณะ และคุณสมบัติที่เหมือนกัน เพื่อเป็นประโยชน์ในการศึกษาในแต่ละส่วนของตารางธาตุ โดยคาบ ( Period ) เป็นการจัดแถวของธาตุแนวราบ ส่วนหมู่ ( Group ) เป็นการจัดแถวของธาตุในแนวดิ่ง ซึ่งมีรายละเอียดดังต่อไปนี้
- ธาตุหมู่หลัก มีทั้งหมด 8 หมู่ 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
- ธาตุทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
ธาตุอินเนอร์ทรานซิชัน มี 2คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่าคาบแลนทาไนด์ - (Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28 ตัว
- ขนาดไอออน
- ไอออนของโลหะ
ไอออนของโลหะเกิดจากอะตอมให้อิเล็กตรอน แล้วเกิดเป็นไอออนบวก เช่น 11Na มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 1 ให้อิเล็กตรอน 1 ตัว เหลืออิเล็กตรอนเป็น 2, 8 ดังรูป

- การเกิดไอออนบวกนั้น ขนาดของไอออนเล็กกว่าอะตอมเดิม เพราะ ระดับพลังงานลดลง จำนวนโปรตอนมากกว่าอิเล็กตรอน ส่งผลให้แรงดึงดูดของนิวเคลียสต่ออิเล็กตรอนมีค่าสูงขึ้น อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากขึ้น ขนาดของไอออนจึงเล็กลง
ไอออนของโลหะในหมู่เดียวกันจะมีขนาดใหญ่ขึ้นเมื่อเลขอะตอมเพิ่มขึ้น และไอออนของโลหะในคาบเดียวกันจะมีขนาดเล็กลงเมื่อเลขอะตอมเพิ่มขึ้น

- ไอออนของอโลหะ
ไอออนของอโลหะเกิดจากอะตอมรับอิเล็กตรอน แล้วเกิดไอออนลบซึ่งใหญ่กว่าอะตอมเดิม เพราะอิเล็กตรอนที่รับเพิ่มเข้ามาจะผลักกับอิเล็กตรอนเดิม ทำให้อิเล็กตรอนอยู่ไกลจากนิวเคลียสมากขึ้น ขนาดไอออนจึงใหญ่ขึ้น เช่น 17Cl มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 7 รับอิเล็กตรอน 1 ตัว มีการจัดเรียงอิเล็กตรอนเป็น 2, 8, 8 ดังรูป
ไอออนของอโลหะในหมู่เดียวกันจะมีขนาดใหญ่ขึ้นเมื่อเลขอะตอมเพิ่มขึ้น และไอออนของอโลหะในคาบเดียวกันจะมีขนาดเล็กลง เมื่อเลขอะตอมเพิ่มขึ้น






