พันธะเคมี(Chemical Bond)
พันธะเคมี (Chemical Bonding) คือ แรงยึดเหนี่ยวที่เกิดขึ้นระหว่างอนุภาคมูลฐานหรืออะตอม (Atom) ซึ่งเป็นการดึงดูดเข้าหากัน เพื่อสร้างเสถียรภาพในระดับโมเลกุล
จนเกิดเป็นสสารหรือสารประกอบที่มีโครงสร้างขนาดใหญ่และมีความซับซ้อนมากขึ้นในธรรมชาติ ไม่ว่าจะเป็นน้ำ อากาศ พื้นดิน ก้อนหิน ต้นไม้ รวมไปถึงเนื้อเยื่อและร่างกายของสิ่งมีชีวิต ซึ่งทุกสสารในจักรวาลล้วนถูกสร้างขึ้นจากการรวมตัวกันของอนุภาคพื้นฐานขนาดเล็กเหล่านี้
พันธะเคมี เป็นแรงดึงดูดที่เกิดขึ้นจากความไม่เสถียรของอะตอมหรือธาตุต่าง ๆ ในธรรมชาติ ซึ่งกว่า 90 ธาตุที่พบในธรรมชาติ มีเพียงธาตุในหมู่ VIIIA หรือก๊าซเฉื่อย (Inert Gas) เท่านั้นที่สามารถคงอยู่ในรูปของอะตอมอิสระ จากการมีอิเล็กตรอนวงนอกสุดเต็มตามจำนวนในแต่ละระดับชั้นของพลังงาน หรือ มีเวเลนซ์อิเล็กตรอน (Valence Electron) ครบ 8 ตัว
พันธะเคมีคือแรงดึงดูดที่ยึดอะตอมเข้าด้วยกันเป็นโมเลกุล
(An attractive force that holds atoms together to form molecules)
• การสร้างพันธะเป็นกระบวนการคายพลังงาน
(ทําให้อะตอมมีความเสถียรเพิ่มขึ ้น)
• การทําลายพันธะเป็ นกระบวนการดูดพลังงาน
พันธะเคมีแบ่งออกเป็นประเภทหลัก ๆ ดังนี ้
1.พันธะไอออนิก (Ionic Bond)
2.พันธะโควาเลนต์ (Covalent Bond)
3.พันธะโลหะ (Metallic Bond)
พันธะไอออนิก (Ionic bond)
พันธะไอออนิก ( Ionic bond ) เป็นแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก โลหะส่วนใหญ่มีค่าอิเล็กโตรเนกาติวิตีต่ำจึงเสียอิเล็กตรอนให้แก่อะตอมของอโลหะซึ่งมีค่าอิเล็กโตรเนกาติวิตีสูง และทำให้อิเล็กตรอนที่อยู่รอบ ๆ อะตอมครบ 8 ( octat rule ) โลหะกลายเป็นไอออนบวก และอโลหะกลายเป็นไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น โดยแรงดึงดูดจะแปรผันโดยตรงกับจำนวนประจุบวกและลบของไอออนทั้งสองที่ยึดติดกัน ดังนั้นค่าประจุยิ่งมาก แรงดึงดูดยิ่งมาก พันธะยิ่งแข็งแรง และแรงดึงดูดจะแปรผกผันกับระยะทางระหว่างไอออนทั้งสอง ไอออนบวกและไอออนลบอยู่ห่างกันมาก แรงดึงดูดจะน้อยลง
หลักการเรียกชื่อสารประกอบไอออนิก
- เรียกชื่อไอออนบวกตามด้วยไอออนลบ
- เรียกไออนบวกที่เป็นไอออนของอะตอมเดี่ยวตามชื่อของธาตุนั้น เช่น Ca2+ อ่านว่า แคลเซียม
Na+ อ่านว่า โซเดียม Al3+ อ่านว่า อลูมิเนียม H+ อ่านว่า ไฮโดรเจน Ag+ อ่านว่า ซิลเวอร์ เป็นต้น
- ไอออนบวกของโลหะทรานสิชันที่มีเลขออกซิเดชันหลายค่า จะเขียนชื่อธาตุ ตามด้วยเลขออกซิเดชันเป็นเลขโรมันในเครื่องหมายวงเล็บ และให้เรียกชื่อด้วยภาษากรีก ( ถ้ามี ) แล้วลงท้ายไอออนที่มีเลขออกซิเดชันมากด้วย “อิก ( – ic )” และลงท้ายไอออนที่มีเลขออกซิเดชันน้อยด้วย “อัส ( – ous )”
ภาพที่ 1 แสดงโครงสร้างผลึกของ Nacl (สารประกอบไอออนิกชนิดหนึ่ง)
หลักการเขียนสูตรสารประกอบไอออนิก
- พิจารณาว่าสารประกอบนั้นประกอบด้วยธาตุชนิดใด
- ธาตุโลหะหมู่ 1-12 มักเป็นไอออนบวก
- ธาตุอโลหะหมู่ 16-17 มักเป็นไอออนลบ
- ธาตุในหมู่ 13-15 อาจเป็นไอออนลบหรือไอออนบวกก็ได้ขึ้นอยู่กับชนิดของสาร
- ไอออนบวกหรือไอออนลบ อาจเป็น ไอออนของธาตุเดี่ยว เช่น Na+, Br–, Mg2+, Cl– หรือกลุ่มอะตอมก็ได้ เช่น NH4+, NO3–
คุณสมบัติของสารประกอบไอออนิก
อะตอมที่รวมตัวกันด้วยพันธะไอออนิก มีชื่อเรียกว่า “สารประกอบไอออนิก” เป็นสารประกอบมีขั้ว โดยมีคุณสมบัติในการนำไฟฟ้าได้ต่ำ เมื่ออยู่ในสถานะของแข็ง แต่จะนำไฟฟ้าได้ดี เมื่ออยู่ในรูปของสารละลาย เป็นสารประกอบที่มีจุดหลอมเหลวและจุดเดือดสูง
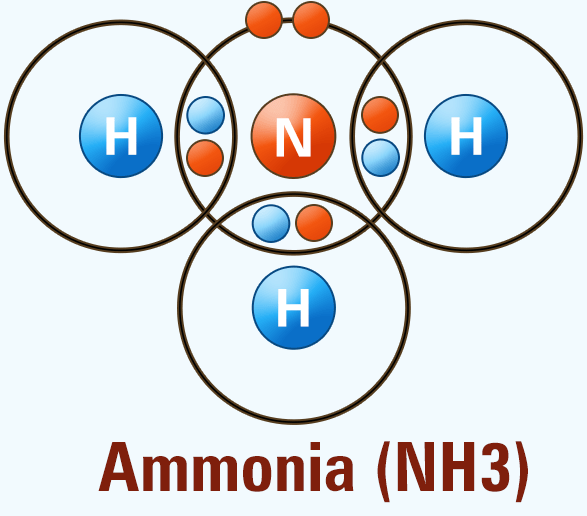
พันธะโคเวเลนต์ (Covalent Bond) คือ พันธะที่เกิดขึ้นจากการใช้เวเลนต์อิเล็กตรอน 1 คู่หรือมากกว่าร่วมกันระหว่างอะตอม ซึ่งโดยส่วนใหญ่ มักเกิดขึ้นจากการรวมตัวกันของอะตอมหรือธาตุในกลุ่มอโลหะ ซึ่งมีพลังงานไอออไนเซชันหรือแรงยึดเหนี่ยวระหว่างอิเล็กตรอนสูง ทำให้การจับคู่กันกลายเป็นการแบ่งปันอิเล็กตรอนร่วมกัน โดยไม่มีอะตอมตัวใดสูญเสียอิเล็กตรอนไปอย่างถาวร
พันธะโคเวเลนต์ สามารถจำแนกออกได้อีก 3 ลักษณะ ตามจำนวนคู่ของอิเล็กตรอนที่ใช้ร่วมกัน คือ
- พันธะเดี่ยว (Single Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 คู่ เช่น น้ำ (H2O) แอมโมเนีย (NH3) และมีเทน (CH4) เป็นต้น
- พันธะคู่ (Double Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 2 คู่ เช่น ก๊าซออกซิเจน (O2) คาร์บอนไดออกไซด์ (CO2) และอีเทน (C2H4) เป็นต้น
- พันธะสาม (Triple Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 คู่ เช่น ก๊าซไนโตรเจน (N2) ก๊าซอะเซทิลีน (C2H2) และคาร์บอนมอนออกไซด์ (CO) เป็นต้น
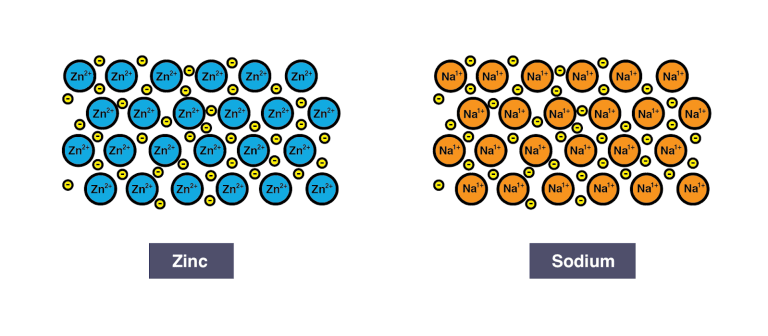
พันธะโลหะ (Metallic bond) หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเองสมบัติทั่วไปของโลหะ
- โลหะเป็นตัวนำไฟฟ้าที่ดี เพราะอิเล็กตรอนเคลื่อนที่ได้ง่าย
- โลหะมีจุดหลอมเหลวสูง เพราะเวเลนต์อิเล็กตรอนของอะตอมทั้งหมดในก้อนโลหะยึดอะตอมไว้อย่างเหนียวแน่น
- โลหะสามารถตีแผ่เป็นแผ่นบางๆได้ เพราะมีกลุ่มเวเลนต์อิเล็กตรอนทำหน้าที่ยึดอนุภาคให้เรียงกันไม่ขาดออกจากกัน
- โลหะมีผิวเป็นมันวาว เพราะกลุ่มอิเล็กตรอนที่เคลื่อนที่โดยอิสระมีปฏิกิริยาต่อแสง จึงสะท้อนแสงทำให้มองเห็นเป็นมันวาว
- สถานะปกติเป็นของแข็ง ยกเว้น Hg เป็นของเหลว
- โลหะนำความร้อนได้ดี เพราะอิเล็กตรอนอิสระเคลื่อนที่ได้ทุกทิศทาง
สมบัติของโลหะ
โลหะนำไฟฟ้าและนำความร้อนได้ดี มีจุดหลอมเหลวสูงและสามารถตีแผ่เป็นแผ่นหรือถูกยืดขยายได้ง่ายโดยไม่แตกหัก เนื่องจากมีกลุ่มเวเลนต์อิเล็กตรอน ทำหน้าที่ยึดอนุภาคให้เรียงร้อยต่อกันอย่างเหนี่ยวแน่น นอกจากนี้ โลหะยังมีผิวเป็นมันวาว จากการเคลื่อนที่โดยอิสระของกลุ่มอิเล็กตรอนที่ก่อให้เกิดปฏิกิริยาต่อแสงไฟที่สะท้อนกลับมา
พลังงานพันธะ หรือ พลังงานสลายพันธะ (Bond dissociation
energy, D) คือ พลังงานที่ต้องใช้ในการสลายพันธะเคมีแต่ละ
พันธะในโมเลกุล (มีค่าเป็ นบวก) เช่น
H2
(g)→2H(g) D(H—H) = 436 kJ/mol
พันธะเคมีชนิดเดียวกันในโมเลกุลที่ต่างกันอาจมีค่าพลังงาน
สลายพันธะต่างกัน เช่น C-H
• CH4(g)→CH3(g) + H(g) D(H-C)CH4 = 436 kJ/mol
• CH3(g)→CH2(g) + H(g) D(H-C)CH3= 368 kJ/mol
• CH2(g)→CH(g) + H(g) D(H-C)CH2= 519 kJ/mol
• CH(g) →C(g) + H(g) D(H-C)CH = 335 kJ/mol






