ฟิสิกส์อะตอม
1. แบบจำลองของอะตอม
2. แบบจำลองของทอมสัน
3. การทดลองของทอมสัน
4. แบบจำลองชองรัทเทอร์ฟอร์ด
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม
เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้
1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
– อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
– อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
– อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน

ทรงกลมตันมีขนาดเล็กที่สุดซึ้งแบ่งแยกอีกไม่ได้
แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทด
ในปลายคริสต์ศตวรรษที่ 19 ได้มีการค้นพบรังสีชนิดหนึ่ง ซึ่งเรียกว่า รังสีแคโทด (cathode ray) ที่ได้จากการทดลองของนักวิทยาศาสตร์ชื่อ Julius Plicker ซึ่งใช้หลอดแก้วที่สูบอากาศออก และมีอิเล็กโตรด 2 อันอยู่คนละข้าง (แอโนดเป็นขั้วไฟฟ้าบวก และแคโทดเป็นขั้วไฟฟ้าลบ) ของหลอดแก้ว และต่อไปยังไฟฟ้าที่มีศักย์สูง ทำให้เกิดรังสีขึ้นภายในหลอดแก้ว เรียกว่า รังสีแคโทด

ภาพหลอดรังสีแคโทด
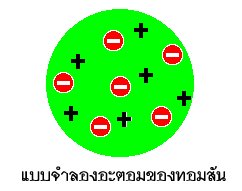
และในปี 1897 ได้มีผู้ทำการทดลองเกี่ยวกับรังสีแคโทดนี้ โดยค้นพบว่ามีอนุภาคที่มีประจุไฟฟ้าลบ ซึ่งต่อมาเรียกว่า “อิเล็กตรอน” จากรังสีแคโทด เขาผู้นี้คือ เซอร์โจเซฟ จอห์น ทอมสัน ( Sir Joseph John Thomson ) ดังนั้นความเชื่อที่เข้าใจกันว่าอะตอมแบ่งแยกอีกไม่ได้ จึงไม่ถูกต้องอีกต่อไป และ ทอมสันได้เสนอแบบจำลองอะตอมขึ้นใหม่ ดังนี้”อะตอมมีลักษณะเป็นรูปทรงกลมประกอบด้วยอนุภาคที่มีประจุบวก และมีอิเล็กตรอนซึ่งมีประจุไฟฟ้าลบ อะตอมโดยปกติอยู่ในสภาพเป็นกลางทางไฟฟ้า ซึ่งทำให้ทั้งสองประจุนี้มีจำนวนเท่ากันและกระจายอยู่ทั่วไปอย่างสม่ำเสมอภายในอะตอม โดยมีการจัดเรียงที่ทำให้อะตอมมีสภาพเสถียรมากที่สุด” ดังรูป
แต่แบบจำลองอะตอมของทอมสันนี้ยังไม่สามารถอธิบายข้อสงสัยบางอย่างได้ เช่น ประจุไฟฟ้าบวก อยู่กันได้อย่างไรในอะตอม และ ไม่สามารถอธิบายคุณสมบัติอื่นๆของอะตอม ตัวอย่างเช่น สเปกตรัมที่แผ่ออกมาจากธาตุ จึงมีนักวิทยาศาสตร์รุ่นต่อมาค้นคว้าและทดลองเพื่อหาข้อเท็จจริงต่อมา และปัจจุบันก็ได้ทราบว่าแบบจำลองนี้ไม่ถูกต้อง
ทำอย่างไรจึงค้นพบ
ทอมสัน ได้ทำการทดลองเกี่ยวกับการนำไฟฟ้าของแก๊สในหลอดรังสีแคโทด
วิธีทำการทดลองและผลการทดลอง
หลอดรังสีแคโทด เป็นหลอดแก้วที่สูบอากาศออกหมด แล้วบรรจุแก๊สเข้าไป เมื่อให้กระแสไฟฟ้า 10,000 โวลต์ แล้ววางฉากเรืองแสงที่ฉาบด้วยซิงค์ซัลไฟต์(ZnS) ไว้ภายในหลอด จะเห็นเส้นเรืองแสงสีเขียวพุ่งจากแคโทด (ขั้วลบ) ไปยังแอโนด (ขั้วบวก) เรียกรังสีนี้ว่า “รังสีแคโทด”
เพื่อความมั่นใจว่ารังสีนั้นพุ่งจากแคโทดไปยังแอโนดจริง เขาจึงดัดแปลงหลอดรังสีแคโทดใหม่ ทำให้เขาเห็นรังสีพุ่งเป็นเส้นตรงมาจากแคโทดไปกระทบกับฉากเรืองแสง
เขาทำการทดลองต่อไป เพื่อทดสอบสมบัติของรังสีนี้ โดยเพิ่มขั้วไฟฟ้า 2 ขั้วเพื่อทำให้เกิดสนามไฟฟ้า พบว่ารังสีเบี่ยงเบนเข้าหาขั้วบวก เขาจึงสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบ
นอกจากนี้ เขาได้ทดลองให้รังสีแคโทดอยู่ในสนามแม่เหล็ก ปรากฎว่ารังสีเบนไปอีกทิศทางหนึ่งซึ่งตรงกันข้ามกับรังสีแคโทดที่อยู่ในสนามไฟฟ้า
จะได้ว่า เมื่อรังสีแคโทดอยู่ในสนามไฟฟ้าหรือสนามแม่เหล็ก รังสีจะเบนไปจากแนวเดิม โดยรังสีจะวิ่งไปหาขั้วบวกของสนามไฟฟ้า ส่วนสนามแม่เหล็กนั้นรังสีวิ่งไปหาขั้วใต้ ดังนั้นเขาจึงผ่านสนามไฟฟ้าหรือสนามแม่เหล็กไปยังรังสีแคโทด แล้วใช้อีกสนามหนึ่งมาทำให้รังสีเบนกลับเป็นเส้นตรงเหมือนเดิม แรงผลักของไฟฟ้าจะบอกว่ามีกี่ประจุ ส่วนแรงผลักจากสนามแม่เหล็กนั้นจะบอกว่าอนุภาคมีน้ำหนักเท่าใด เขาจึงหาอัตราส่วนประจุต่อมวลของอิเล็กตรอนได้
สรุปผลการทดลอง
อิเล็กตรอนเป็นองค์ประกอบร่วมที่พบในธาตุใดก็ได้ เพราะเมื่อเขาทำการทดลองซ้ำโดยเปลี่ยนชนิดของโลหะที่ใช้เป็นขั้วแคโทด และเปลี่ยนชนิดของแก๊สที่บรรจุ แต่ผลการทดลองยังได้เหมือนเดิม
อิเล็กตรอนเป็นอนุภาคที่มีประจุลบ
อัตราส่วนประจุต่อมวลของอิเล็กตรอนเท่ากับ 1.76 X 108 คูลอมบ์ต่อกรัม
แบบจำลองอะตอมของทอมสัน
เมื่อทอมสันพบว่าอิเล็กตรอนเป็นอนุภาคทึ่มีประจุลบในอะตอม ประกอบกับความเชื่อที่ว่าอะตอมเป็นกลางทางไฟฟ้า นั่นคือมีจำนวนประจุบวกเท่ากับประจุลบ เขาจึงเสนอโครงสร้างอะตอมว่า อะตอมมีรูปร่างเป็นทรงกลม และมีอนุภาคภายในคือประจุบวกและประจุลบปนกันไปอย่างสม่ำเสมอในปริมาณที่เท่ากัน
ใน ค.ศ. 1906 เออร์เนสต์ รัทเธอร์ฟอร์ด( Ernest Rutherford ) และคณะได้ทดลองยิงอนุภาคแอลฟา ( เป็นนิวเคลียสของอะตอมฮีเลียม ซึ่งได้มาจากการสลายของธาตุกัมมันตรังสี เช่น เรเดียม) ไปที่แผ่นโลหะบาง พบว่าอนุภาคแอลฟาส่วนใหญ่สามารถผ่านแผ่นโลหะได้ โดยมีการกระเจิง ( การเบนจากแนวการเคลื่อนที่เดิมไปในทิศทางต่างๆกันของอนุภาค การทดลองการกระเจิงของอนุภาคเป็นวิธีหนึ่งที่ใช้ในการศึกษาเกี่ยวกับโครงสร้างอะตอม ) น้อยมาก และมีอนุภาคแอลฟาบางอนุภาคกระเจิงจากแนวเดิมเป็นมุมกว้างและมีบางตัวสะท้อนกลับทางเดิม ทำให้รัทเธอร์ฟอร์ดสรุปว่า ในอะตอม อนุภาคที่มีประจุไฟฟ้าบวกควรรวมกันอยู่ในปริมาตรเล็กๆที่ศูนย์กลาง จากการค้นพบนี้ทำให้รู้ว่าแบบจำลองอะตอมของทอมสันไม่ถูกต้อง
แบบจำลองชองรัทเทอร์ฟอร์ด
รัทเธอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมขึ้นใหม่ว่า อะตอมประกอบด้วยประจุไฟฟ้าบวกที่รวมกันอยู่ที่ศูนย์กลาง เรียกว่านิวเคลียส ซึ่งถือว่าเป็นที่รวมมวลเกือบทั้งหมดของอะตอม โดยมีอิเล็กตรอนเคลื่อนที่รอบๆนิวเคลียส ด้วยระยะห่างจากนิวเคลียสมาก เมื่อเทียบกับขนาดของนิวเคลียส และระหว่างนิวเคลียสกับอิเล็กตรอนจึงเป็นที่ว่าง
เนื่องจากแบบจำลองอะตอมของรัทเธอร์ฟอร์ด ยังมีข้อบกพร่องบางประการ เช่น ไม่สามารถอธิบายได้ว่าทำไมอิเล็กตรอนจึงวนรอบนิวเคลียสได้ โดยไม่สูญเสียพลังงาน และทำไมประจุไฟฟ้าบวกจึงรวมกันอยู่ภายในนิวเคลียสได้ ทั้งๆที่มีแรงผลักเนื่องจากประจุไฟฟ้าชนิดเดียวกัน จึงทำให้นักฟิสิกส์พยายามหาแบบจำลองอะตอมขึ้นใหม่






