สมบัติและการนำไปใช้ประโยชน์ของของแข็ง
สถานะต่างๆของสสาร
ของแข็ง(Solids)มีลกัษณะทั่วไปคือ มีปริมาตรที่แน่นอน มีรูปร่างที่แน่นอนโมเลกุลถูกยึดเหนี่ยวกัน ของเหลวทุกชนิดเมื่อเย็นลงจนถึงอุณหภูมิหนึ่งจะกลายเป็นของแข็ง เนื่องจากของแข็งมีอนุภาคอยู่ชิดกัน ทำให้มีช่องว่างระหว่างโมเลกุลน้อยดังนั้นอนุภาคที่เคยเคลื่อนที่ไปมาได้อย่างค่อนข้างอิสระจึงถูกจำกัดการที่อนุภาคของของแข็งเคลื่อนที่ได้น้อยจึงทำให้มีพลังงานจลน์น้อย แต่อย่างไรก็ตามอนุภาคของของแข็งก็ยังคงสั่นได้ ดังนั้น จึงมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากกว่าและเป็นเหตุให้ของแข็งมีรูปร่างแน่นอนไม่เปลี่ยนแปลงไปตามภาชนะที่บรรจุ
สมบัติทั่ว ๆ ไป
- มีลักษณะแข็งแกร่ง มีรูปร่างแน่นอนไม่เปลี่ยนแปลงไปตามภาชนะที่บรรจุทั้งนี้เพราะอนุภาคที่ประกอบกันเป็นของแข็งจัดเรียงตัวอยู่ในตำแหน่งต่าง ๆ ที่แน่นอนและชิดกัน
- ปริมาตรของของแข็งค่อนข้างคงที่ การเปลี่ยนแปลงความดันเกือบจะไม่มีผลต่อการเปลี่ยนปริมาตรของของแข็งสำหรับอุณหภูมิมีผลต่อของแข็งน้อยเช่นเดียวกันเมื่อของแข็งได้รับความร้อน จะมีการขยายตัวเนื่องจากการสั่นสะเทือนของอนุภาคจะหดตัวเมื่ออุณหภูมิลดลง แต่การขยายตัวและหดตัวมีค่าน้อยมากเมื่อเปรียบเทียบกับของเหลวและก๊าซ
- ของแข็งมีความหนาแน่นมากกว่าของเหลว เพราะมีแรงยึดเหนี่ยวระหว่างอนุภาคมากทำให้อยู่ชิดกันเป็นระเบียบทางเรขาคณิต
- ของแข็งมีการแพร่ช้ามาเมื่อเปรียบเทียบกับของเหลวและก๊าซ
- ของแข็งบางชนิดเป็นตัวนำไฟฟ้าและความร้อนบางชนิดเป็นสารกึ่งตัวนำและสารบางชนิดเป็นฉนวน
- ของแข็งบางชนิดสามารถจัดเรียงตัวเป็นรูปทรงทางเรขาคณิตที่แน่นอนได้เรียกว่าผลึกบางชนิดอาจจะมีผลึกได้หลายแบบและบางชนิดไม่สามารถมีผลึกได้เรียกว่าของแข็งอสัณฐาน (Amorphous solid)
คุณสมบัติทั่วไปของของแข็ง
สารที่อยู่ในสถานะของแข็งจะมีแรงยึดเหนี่ยวระหว่างอนุภาค มากกว่าของเหลวและก๊าซ จึงเป็นเหตุผลหนึ่งที่ทำให้จุดหลอมเหลวและจุดเดือดของสาร ในสถานะของแข็งส่วนใหญ่มีค่าสูงกว่ของเหลวและก๊าซ นอกจากนี้ของแข็งยังมีสมบัติเฉพาะตัวที่สำคัญอีกหลายประการคือ มีรูปร่างแน่นอนไม่ขึ้นอยู่กับภาชนะที่บรรจุ มีปริมาตรคงที่ที่อุณหภูมิและความดันคงที่ ไม่สามารถไหลได้ตามภาวะปกติเนื่องจากอนุภาคของแข็งอยู่ชิดกันมาก การจัดเรียงอนุภาคอยู่ในตำแหน่งที่แน่นอน
การจัดเรียงอนุภาคของของแข็ง
การจัดเรียงอนุภาคในของแข็งแบ่งตามลักษณะการจัดเรียงอนุภาคของสารได้ 2 ชนิด คือ
1. ของแข็งที่มีลักษณะเป็นผลึก (crystalline solid)
เป็นของแข็งที่มีพื้นผิวที่ทํามุมกันด้วยค่าที่แน่นอน ซึ่งแสดงถึงการจัดเรียงเป็นระเบียบของอนุภาคของของแข็ง ผลึกที่มีขนาดใหญ่เมื่อทําให้เล็กลงก็ยังคงรักษาลักษณะรูปผลึกเดิมอยู่ สารบางอย่างอาจมีรูปผลึกได้หลายแบบซึ่งเราจะเรียกว่า ปรากฏการณ์อัญรูป (polymorphism) เช่น เพชร แกรไฟต์ สารบางชนิดอาจจะมีรูปร่างผลึกที่เหมือนกันได้ ซึ่งจะเรียกปรากฏการณ์นี้ว่า ภาวะรูปร่างเหมือน (isomorphism) เช่น โซเดียมคลอไรด์ โพแทสเซียมคลอไรด์ เป็นต้น นอกจากนี้ ผลึกยังมีสมบัติที่เรียกว่า anisotropy อันได้แก่ความแข็งแรงทนทานทางกล ดรรชนีหักเห และการนําไฟฟ้า ถ้าวัดในทิศทางที่ต่างกันค่าที่ได้จะไม่เท่ากัน
คุณสมบัติของแข็งที่มีลักษณะเป็นผลึก
– อนุภาคเรียงตัวกันอย่างมีระเบียบแบบแผนทางเรขาคณิตเป็นสามมิติ เรียกว่า Crystal lattice
– ผิวหน้าเรียบ มุมระหว่างผิวหน้ามีค่าแน่นอน
– มีจุดหลอมเหลวแน่นอน
– มีสมบัติไม่เหมือนกันทุกทิศทาง
1.1) โครงสร้างผลึก (crystal structure) ของวัสดุ เรามักจะนึกถึงอะตอมหรือไอออนในรูปของทรงกลมทีจัดเรียงตัวอย่างเป็นระเบียบในระบบโครงข่ายสามมิติ หรือที่เรียกว่า แลตทิซ (lattice) จุดตัดบนโครงข่ายสามมิตินี้เรียกว่า จุดแลตทิซ (lattice point) ซึ่งแสดงถึงอะตอมของในโครงข่าย แต่ละส่วนย่อยที่จัดเรียงตัวซ้ำๆกันในแลตทิซเรียกว่า ยูนิตเซลล์ (unit cell) ซึ่งกำหนดด้วยความยาวแต่ละด้าน a,b,c
โครงสร้างผลึก
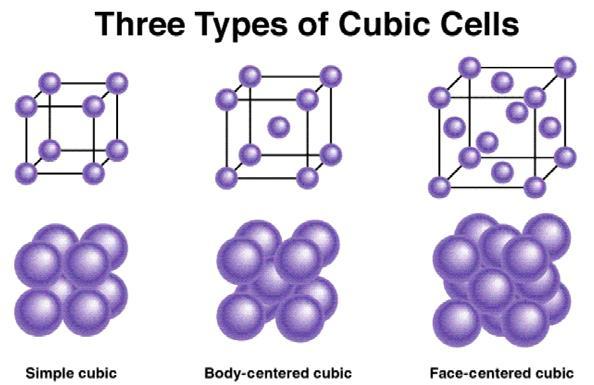
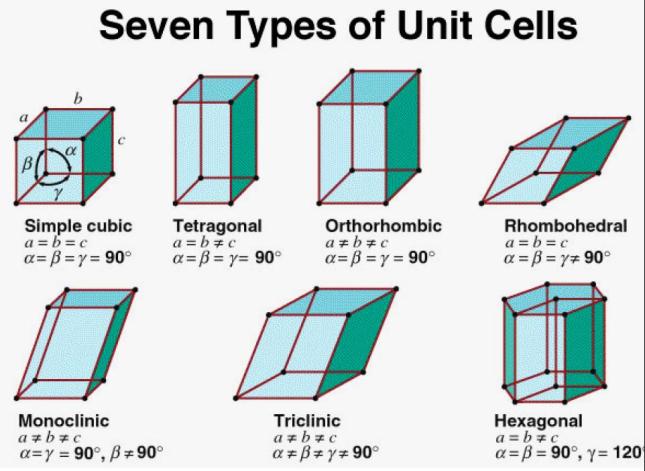
1.2) ยูนิตเซลล์มีทั้งหมด 7 แบบ แต่ละแบบมีความยาวของแต่ละด้านและมุมที่ด้านประกอบกันแตกต่างกันออกไป เราเรียกยูนิตเซลล์ทั้ง 7 แบบนี้ว่า ระบบผลึก (crystal system) ยกตัวอย่างเช่น ระบบผลึกคิวบิก (cubic) เป็นระบบผลึกที่แต่ละด้านมีความยาวเท่ากันและทำมุมกัน 90 องศา หรือ ระบบผลึกออร์โธรอมบิก (orthorhombic) ที่แต่ละด้านทำมุมกัน 90 องศา แต่ว่ามีความยาวไม่เท่ากัน
ระบบผลึกทั้ง 7 แบบ
2. ของแข็งอสัณฐาน (amorphous solid) ของแข็งที่อนุภาคอยู่ปะปนกันอย่างไม่เป็นระเบียบ ไม่มีรูปร่างที่แน่นอนเช่น แก้ว โพลิเมอร์ ยางธรรมชาติ ฯลฯ มีสมบัติทั่วๆ ไปคล้ายผลึก แตกต่างกันที่ไม่มีรูปทรงเรขาคณิตที่แน่นอน ดังนั้นจึงมีสมบัติที่เรียกว่า isotropy คือ ค่าดรรชนีหักเห การนําไฟฟ่า และคุณสมบัติอื่นๆ จะเหมือนกันหมดทุกทิศทาง นอกจากนี้ของแข็งอสัณฐานจะมีจุดหลอมเหลวไม่เด่นชัด เมื่อได้รับความร้อนจะค่อยๆ อ่อนตัวจนกระทั่งไหลได้ อุณหภูมิที่ของแข็งชนิดนี้หลอมตัวจึงอยู่ในช่วงที่ยาว ต่างจากผลึกซึ่งจะมีจุดหลอมเหลวที่เด่นชัดและอุณหภูมิที่ของแข็งชนิดนี้หลอมตัวอยู่ในช่วงที่แคบ
– อนุภาคเรียงตัวโดยไม่มีระเบียบแบบแผน
– ผิวหน้าไม่เรียบ และมุมต่างๆ กัน
– ช่วงการหลอมเหลวกว้าง
– มีสมบัติเหมือนกันทุกทิศทาง
โครงสร้างของแข็งอสัณฐาน
ผลึกควอตซ์
การเปลี่ยนสถานะของของแข็ง
1. การหลอมเหลว เมื่อของแข็งได้รับความร้อน อนุภาคจะมีพลังงานจลน์ของการสั่นมากขึ้น จนในที่สุดความสั่นสะเทือนรุนแรงถึงขีดที่อนุภาคหลุดออกจากที่ในแลตทิชผลึกและเคลื่อนที่ไปมาได้ ความเป็นระเบียบของอนุภาคภายในของแข็งสิ้นสุดลง ของแข็งจึงเปลี่ยนเป็นของเหลว อุณหภูมินั้นเป็นจุดหลอมเหลวของของแข็ง และเป็นอุณหภูมิเดียวกันกับอุณหภูมิที่ของเหลวเปลี่ยนเป็นของแข็งหรือที่เรียกว่า ” จุดเยือกแข็ง ” จุดหลอมเหลวปกติ หมายถึง จุดหลอมเหลวของของแข็งที่ความดัน 1 บรรยากาศ ในระหว่างการหลอมเหลว ของแข็งอยู่ในสมดุลกับของเหลว จุดหลอมเหลวของของแข็ง เป็นอุณหภูมิที่ของแข็งและของเหลวอยู่ร่วมกันในสมดุล ที่อุณหภูมิ 0 องศาเซลเซียส
2. การระเหิด เนื่องจากอนุภาคของของแข็งอยู่ใกล้กันมาก ทำให้มีโอกาสกระทบกันได้ จึงมีการถ่ายเทพลังงานให้แก่กันที่อุณหภูมิหนึ่งบางอนุภาคที่ผิวหน้าของของแข็งมีพลังงานสูงพอที่จะหลุดเป็นปรากฏการณ์ที่ของแข็งเปลี่ยนสถานะเป็นไอ โดยไม่ผ่านสถานะของเหลวก่อน เรียกว่า ” การระเหิด ” จึงทำให้ แนฟทาลีนมีขนาดเล็กลงและหมดไปในที่สุดได้สารที่ระเหิดได้ นอกจากแนฟทาลีนแล้วยังมี การบูร พิมเสน ไอโอดีน เป็นต้น






