เคมีออนไลน์เรื่องเเบบจำลองอะตอมเเละตารางธาตุ
โครงสร้างอะตอม
– แบบจำลองอะตอมดอลตัน
– แบบจำลองอะตอมทอมสัน
– แบบจำลองอะตอมรัทเทอร์ฟอร์ด
– แบบจำลองอะตอมของโบว์
– แบบจำลองอะตอมกลุ่มหมอก
วิวัฒนาการของแบบจำลองอะตอม
เนื่องจากอะตอมมีขนาดเล็กมาก ไม่สามารถมองเห็นด้วยตาเปล่า ความรู้เกี่ยวกับอะตอมจึงได้มาจากการแปลผลข้อมูลที่ได้จากการทดลอง และนำมาสร้างเป็นแบบจำลองซึ่งมีวิวัฒนาการดังนี้
ในปี พ.ศ. 2346 เซอร์ จอห์น ดอลตัน (Sir John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีเกี่ยวกับอะตอมว่าอะตอมมีขนาดเล็กแบ่งแยกและทำให้สูญหายไม่ได้อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกันแต่จะแตกต่างจากอะตอมของธาตุอื่น นอกจากนี้ดอลตันยังเสนอว่า สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อย ๆ
สรุปแนวคิดของ
จอห์น ดอลตัน
1. สสารประกอบขึ้นจากอนุภาคที่เล็กที่สุด เรียกว่าอะตอม มีลักษณะเป็นทรงกลมตัน ที่ไม่สามารถแบ่งแยกได้อีก
2. อะตอมไม่สามารถสร้างขึ้นใหม่ หรือทำลายได้
3. อะตอมของธาตุชนิดเดียวกัน จะมีคุณสมบัติเหมือนกัน
3.1 ในทางกลับกันอะตอมของธาตุต่างชนิดกัน จะมีสมบัติต่างกัน
4. เมื่ออะตอมของธาตุต่างชนิดกันมารวมตัวกัน จะเกิดเป็นสารประกอบ
4.1 โดยสารประกอบจะมีอัตราส่วนของธาตุเป็นเลขลงตัวจำนวนต่ำๆ
2. แบบจำลองอะตอมของ ทอมสัน (1904)
ทอมสัน
1. อะตอมเป็นทรงกลมที่เป็นกลางทางไฟฟ้า ซึ่งประกอบขึ้นด้วยอนุภาคที่มีประจุบวกและอนุภาคที่มีประจุลบ ซึ่งมีค่าประจุไฟฟ้าเท่ากัน
2. ประจุบวกและประจุลบของอะตอมจะกระจายตัวอยู่ทั่วทั้งอะตอมอย่างสม่ำเสมอ โดยประจุลบจะฝังตัวอยู่ในเนื้ออะตอมที่มีประจุบวก
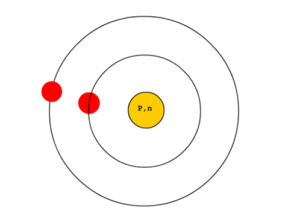
แบบจำลองอะตอมรัทเทอร์ฟอร์ด
เออร์เนสต์ รัทเธอร์ฟอร์ด (Ernest Rutherford) ได้ทำการทดลองยิงอนุภาคแอลฟา ( นิวเคลียสของอะตอมฮีเลียม ) ไปที่แผ่นโลหะบาง ในปี พ.ศ.2449 และพบว่าอนุภาคนี้ สามารถวิ่งผ่านได้เป็นจำนวนมาก แต่จะมีเพียงส่วนน้อยที่เป็นอนุภาคที่กระเจิง ( การที่อนุภาคเบนจากแนวการเคลื่อนที่จากที่เดิมไปยังทิศทางต่างๆกัน ) ไปจากแนวเดิมหรือสะท้อนกลับทางเดิม
modelจากการทดลองนี้ รัทเธอร์ฟอร์ดจึงได้เสนอแบบจำลองอะตอมว่า ” อะตอมมีลักษณะโปร่ง ประกอบด้วยประจุไฟฟ้าบวกที่รวมกันอยู่ที่ศูนย์กลางเรียกว่า นิวเคลียส ซึ่งถือว่าเป็นที่รวมของมวลเกือบทั้งหมดของอะตอมโดยมีอิเล็กตรอนเคลื่อนที่รอบๆนิวเคลียสด้วยระยะห่างจากนิวเคลียสมาก เมื่อเทียบกับขนาดของนิวเคลียส และระหว่างนิวเคลียสกับอิเล็กตรอนเป็นที่ว่างเปล่า”
แต่แบบจำลองนี้ยังมีข้อกังขาที่ยังไม่สามารถหาคำตอบได้คือ
1.อิเล็กตรอนที่เคลื่อนที่โดยมีความเร่งจะแผ่คลื่นแม่เหล็กไฟฟ้าออกมา ทำให้พลังงานจลน์ลดลง ทำไมอิเล็กตรอนวิ่งวนรอบนิวเคลียสตามแบบจำลองของรัทเธอร์ฟอร์ด จึงไม่สูญเสียพลังงาน และไปรวมอยู่ที่นิวเคลียส
2. อะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัว เมื่อวิ่งวนรอบนิวเคลียสจะจัดการเรียงตัวอย่างไร
3. ประจุบวกที่รวมกันอยู่ในนิวเคลียส จะอยู่กันได้อย่างไร ทั้งๆที่เกิดแรงผลัก
แบบจำลองอะตอมของโบร์
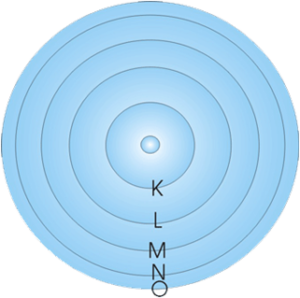
e0b8a3e0b8b9e0b89be0b8a0e0b8b2e0b89e4 นักวิทยาศาสตร์ได้พยายามศึกษาเรื่องเกี่ยวกับอะตอม โดยได้เสนอแบบจำลองอะตอมจากการทดลองที่เกิดขึ้น ซึ่งแบบจำลองของรัทเธอร์ฟอร์ดได้รับการยอมรับแต่ก็ยังไม่สมบูรณ์ จึงมีผู้พยายามหาคำอธิบายเพิ่มเติม โดยในปี 1913 นีล โบร์ (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก ได้ทำการศึกษาการเกิดสเปกตรัมของก๊าซไฮโดรเจน และได้สร้างแบบจำลองอะตอมเพื่อใช้อธิบายลักษณะการเคลื่อนที่ของอิเล็กตรอนรอบ ๆ นิวเคลียสเป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงจะมีระดับพลังงานเฉพาะตัว และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุด ซึ่งมีระดับพลังงานต่ำที่สุด เรียกว่า ระดับพลังงาน K และเรียกระดับพลังงานถัดออกมาว่า ระดับพลังงาน L,M,N,… ตามลำดับ
วิธีทำการทดลอง
เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไป
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้น ที่มีความยาวคลื่นต่างๆเรียงลำดับกันไป
ผลการทดลอง
อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
ระดับพลังงานแต่ละชั้น
เมื่อ 2.18 X 10-18 J = ค่าคงที่ของริดเบิร์ก(Rydberg constant)
n = เลขควอนตัมหลัก = 1, 2, 3
นีลส์ โบร์ ได้เสนอแบบจำลองอะตอมขึ้นมา สรุปได้ดังนี้
1. อิเลคตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. แต่ละระดับพลังงานจะมีอิเลคตรอนบรรจุได้ดังนี้
จำนวนอิเลคตรอน = 2n2
ระดับพลังงาน K
ระดับพลังงาน L
ระดับพลังงาน M
ระดับพลังงาน N
ระดับพลังงาน O
ระดับพลังงาน P
ระดับพลังงาน Q
3. อิเลคตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron) จะเป็นอิเลคตรอนที่เกิดปฏิกิริยาต่าง ๆ ได้
4. อิเลคตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดไว้อย่างดี ส่วนอิเลคตรอนระดับพลังงานวงนอก จะไม่เสถียร เพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก อิเลคตรอนพวกนี้จึงมีพลังงานสูงหลุดออกจากอะตอมได้ง่าย
5. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเลคตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยน ข้ามระดับพลังงานกันก็ได้
แบบจำลองอะตอมกลุ่มหมอก
แบบจำลองอะตอมแบบกลุ่มหมอก แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติม โดยใช้ความรู้ทางกลศาสตร์ควอนตัม สร้างสมการเพื่อคำนวณหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆ จึงสามารถอธิบายเส้นสเปกตรัมของธาตุได้ถูกต้องกว่าอะตอมของโบร์
ลักษณะสำคัญของแบบจำลองอะตอมแบบกลุ่มหมอกอธิบายได้ดังนี้
1. อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็วตลอดเวลาด้วยความเร็วสูง ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่างๆ ปรากฏการณ์แบบนี้นี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่น จะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
2. การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงานจะเป็นรูปทรงกลม
รูปทรงต่างๆของกลุ่มหมอกอิเล็กตรอน จะขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน
การใช้ทฤษฎีควันตัม จะสามารถอธิบายการจัดเรียงตัวของอิเล็กตรอนรอบนิวเคลียส ได้ว่าอิเล็กตรอนจัดเรียงตัวเป็นออร์บิทัล(orbital) ในระดับพลังงานย่อย s , p , d , f แต่ละออร์บิทัล จะบรรจุอิเล็กตรอนเป็นคู่ ดังนี้
s – orbital มี 1 ออร์บิทัล หรือ 2 อิเล็กตรอน
p – orbital มี 3 ออร์บิทัล หรือ 6 อิเล็กตรอน
d – orbital มี 5 ออร์บิทัล หรือ 10 อิเล็กตรอน
f – orbital มี 7 ออร์บิทัล หรือ 14 อิเล็กตรอน
แต่ ละออร์บิทัลจะมีรูปร่างลักษณะแตกต่างกัน ขึ้นอยู่กับการเคลื่อนที่ของอิเล็กตรอนในออร์บิทัล และระดับพลังงานของอิเล็กตรอนในออร์บิทัลนั้นๆ เช่น
s – orbital มีลักษณะเป็นทรงกลม
p – orbital มีลักษณะเป็นกรวยคล้ายหยดน้ำ ลักษณะแตกต่างกัน 3 แบบ ตามจำนวนอิเล็กตรอนใน 3 ออร์บิทัล คือ Px , Py , Pz
d – orbital มีลักษณะและรูปทรงของกลุ่มหมอก แตกต่างกัน 5 แบบ ตามจำนวนอิเล็กตรอนใน 5 ออร์บิทัล คือ dx2-y2 , dz2 , dxy , dyz , dxz






