เซลล์อิเล็กโทรไลต์ (Electrolytic Cell)
ส่วนประกอบของเซลล์อิเล็กโทรไลต์
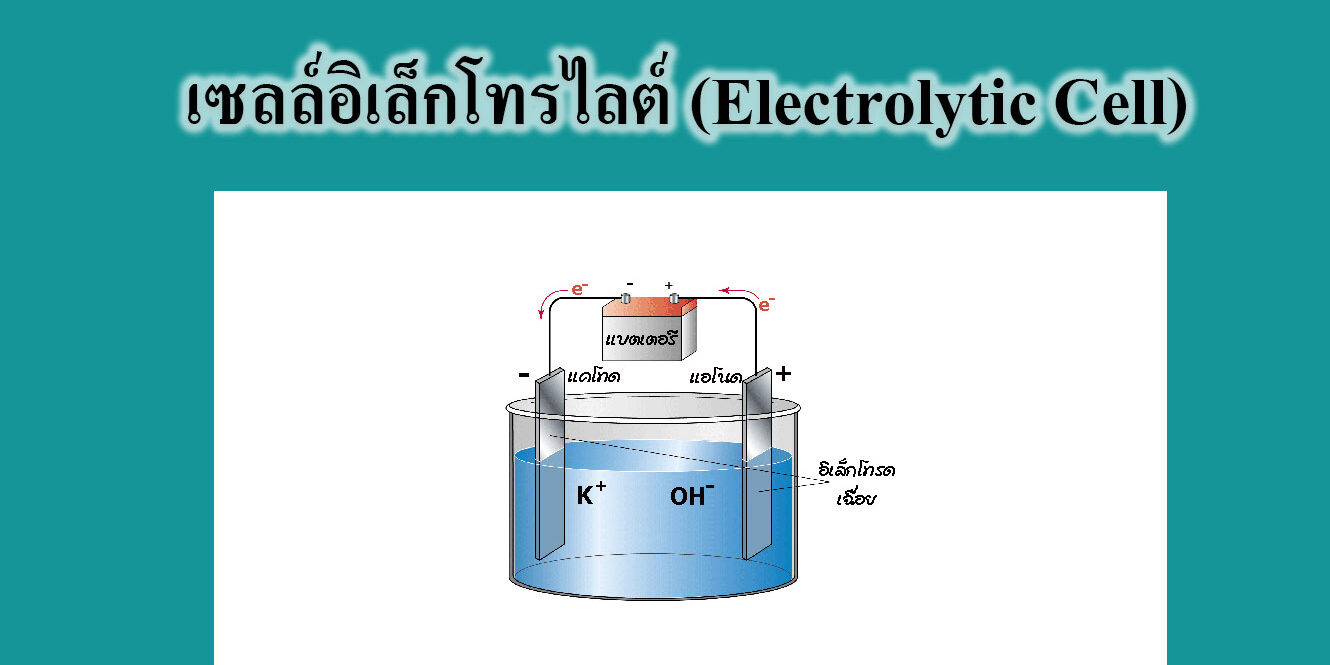
- ขั้วไฟฟ้า (Electrode) คือ แผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้วต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ โดยทั่วไปมักจะใช้ขั้วเฉื่อย เช่น ขั้ว Pt ขั้วไฟฟ้าแบ่งเป็นแอโนด และ แคโทด
สารละลายอิเล็กโทรไลต์ คือสารละลายที่นำไฟฟ้าได้ เพราะมี ไอออนบวก (+) และ ไอออนลบ (-) รวมอยู่ในสารละลายเดียวกัน
ขั้วแอโนด (Anode) เป็นขั้วที่เกิดปฏิกิริยาออกซิเดชัน ซึ่งเป็นขั้วบวก (+) ที่ต่อเข้ากับขั้วบวกของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
ขั้วแคโทด (Cathode) เป็นขั้วที่เกิดปฏิกิริยารีดักชัน ซึ่งเป็นขั้วลบ (-) ที่ต่อเข้ากับขั้วลบของแบตเตอรี่หรือแหล่งกำเนิดไฟฟ้า
- สำหรับไอออนบวก (+) จะวิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชันจึงเรียกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคทไอออน (Cathion) ส่วนไอออนลบ (-) จะเป็นผู้ให้อิเล็กตรอน ที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชันเรียกว่าแอโนด และเรียก ไอออนลบ (-) ว่า แอนไอออน (Anion)
ดังนั้น ที่ Anode มี Anion คือ ไอออนลบ และที่ Cathode มี Cathion คือ ไอออนบวก ส่วน Anode (Oxidation) ตรงกับขั้วบวก Cathode (Reduction) ตรงกับขั้วลบ
เซลล์อิเล็กโทรไลต์ ประกอบด้วย
1. ขั้วไฟฟ้า (Electrode) คือ แผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้วต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ แบ่งเป็น ขั้วแอโนด (Anode) และ ขั้วแคโทด (Cathode)
2. สารละลายอิเล็กโทรไลต์ คือ สารละลายที่นำไฟฟ้าได้ เพราะมีไอออนบวกและไอออนลบ
ไอออนบวก วิ่งไปรับอิเล็กตรอนที่ขั้วลบ เกิดปฏิกิริยารีดักชัน จึงเรียกขั้วลบว่า แคโทด และเรียกไอออนบวกว่า แคตไอออน (cation)
ไอออนลบ วิ่งไปให้อิเล็กตรอนที่ขั้วบวกเกิดปฏิกิริยาออกซิเดชัน เรียกว่า แอโนด และเรียก ไอออนลบว่า แอนไอออน (Anion)
3. เครื่องกำเนิดกระแสตรง (D.C.) เช่น เซลล์ไฟฟ้า หรือ แบตเตอรี่
ประโยชน์ของกระบวนการ อิเล็กโทรลิซิส (Electrolysis)
การใช้ประโยชน์ของกระบวนการอิเล็กโทรลิซิส (Electrolysis) มีหลายอย่างด้วยกัน เช่น การแยกธาตุประกอบของน้ำด้วยไฟฟ้า การแยกสารละลายด้วยกระแสไฟฟ้า การทำโลหะให้บริสุทธิ์โดยใช้เซลล์อิเล็กโทรไลต์ การชุบโลหะด้วยกระแสไฟฟ้า ในที่นี้ขอยกตัวอย่างการการชุบโลหะด้วยกระแสไฟฟ้าซึ่งเป็นที่นิยมในปัจจุบัน
การชุบโลหะด้วยกระแสไฟฟ้า
เมื่อผ่านไฟฟ้ากระแสตรงเข้าไปในเซลล์ ไอออนของโลหะในสารละลายที่มีศักย์ไฟฟ้าสูงกว่าน้ำจะรับอิเล็กตรอนจากวัตถุ (ชิ้นงาน) ที่ต่ออยู่กับขั้วลบของเครื่องกำเนิดไฟฟ้าหรือแคโทด เกิดเป็นอะตอมของโลหะเคลือบติดอยู่ที่ผิวของวัตถุที่นำมาชุบ ขณะเดียวกันโลหะที่ขั้วบวกหรือแอโนดจะเกิดปฏิกิริยาออกซิเดชันได้ไอออนของโลหะที่ละลายอยู่ในสารละลาย เพื่อชดเชยไอออนของโลหะที่เปลี่ยนแปลงไปเป็นอะตอมของโลหะขณะชุบ ดังนั้น แอโนดจะสึกกร่อนไป ส่วนแคโทดจะมีโลหะมาเกาะเพิ่มขึ้น
ขอบคุณแหล่งข้อมูล https://www.scimath.org/
https://web.ku.ac.th